在世界屋脊的严酷环境中,牦牛如何高效转化能量以维系生命?2025年10月27日一项发表于Advanced Science 的题为“The High-Altitude Adaptation Characteristics of Microbiota-Host Cross-Talk in Yak Gastrointestinal Track”的研究揭晓了答案。本研究由中国农业科学院兰州畜牧与兽药研究所完成,博士研究生黄纯为第一作者,阎萍研究员与梁春年研究员为共同通讯作者。团队首次构建了覆盖牦牛全胃肠道的单细胞图谱,不仅发现了参与高原适应的关键细胞BEST4+,更揭示了由转录因子HNF4A/SREBF2主导、上皮细胞与芽孢杆菌等微生物精密协作的独特能量代谢网络,系统阐明了牦牛胃肠道为适应高寒环境所演化出的高效能量供应策略。

发表期刊:Advanced Science
影响因子:14.1
涉及的欧易生物服务产品:单细胞转录组测序
研究背景
牦牛作为研究高原适应的理想模型,因其长期适应青藏高原的低氧、严寒、强紫外线和食物匮乏等极端环境,形成了独特的遗传和生理适应能力。牦牛不仅是生态循环的重要参与者,也是重要的畜牧资源。然而,当前对牦牛胃肠道在细胞层面如何调控营养吸收与能量代谢以应对极端环境的理解仍十分有限。现有研究多依赖于bulk RNA测序,忽略了单细胞水平的异质性和宿主-代谢物-微生物之间的动态互作。因此,本研究旨在构建牦牛GIT的多组织单细胞图谱,系统解析其高海拔适应的细胞与分子机制。
技术路线
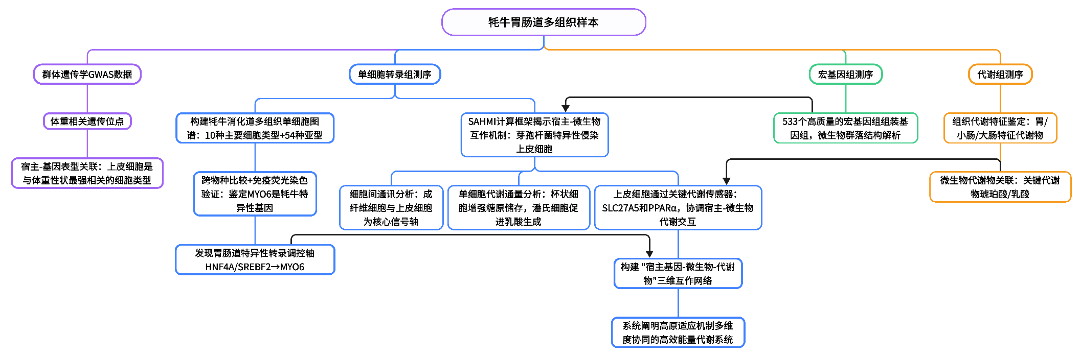
研究内容
本研究首次构建了覆盖牦胃肠道多组织的单细胞转录组图谱,系统揭示了其适应高海拔环境的独特能量代谢机制。研究通过单细胞转录组测序、宏基因组与代谢组等多组学整合分析,不仅鉴定出包括BEST4+细胞在内的54种细胞亚型,更揭示了由HNF4A和SREBF2等关键转录因子主导的基因调控网络。研究进一步发现,上皮细胞作为核心执行者,与胃肠道中特定的芽孢杆菌等微生物协同工作,通过糖原储存、乳酸转化及增强脂质代谢等策略,共同构建了一套高效灵活的能量供应系统,从“细胞-微生物-代谢物”多重互作的维度,完整阐释了牦牛在极端环境下的生存奥秘。
研究结果
一、牦牛胃肠道单细胞转录组图谱的全局景观
基于单细胞RNA测序(scRNA-seq),研究者构建了涵盖前胃(瘤胃、网胃、瓣胃、皱胃)、小肠(十二指肠、回肠)和大肠(结肠、直肠)共8种组织的综合图谱,获得117,019个高质量细胞。鉴定出10种细胞类型(如上皮细胞、成纤维细胞、内皮细胞等)和54种细胞亚型(Figure 1B,C)。其中,发现了一种在人类、小鼠等物种中存在但此前未在反刍动物中报道的BEST4+细胞亚型,推测其在维持胃肠道酸碱平衡和电解质分泌中起重要作用,可能参与高原适应。
细胞周期分析显示,免疫相关细胞(B细胞、T_NK细胞)增殖活跃,而髓系和内皮细胞则处于静息状态。(Figure 1B)
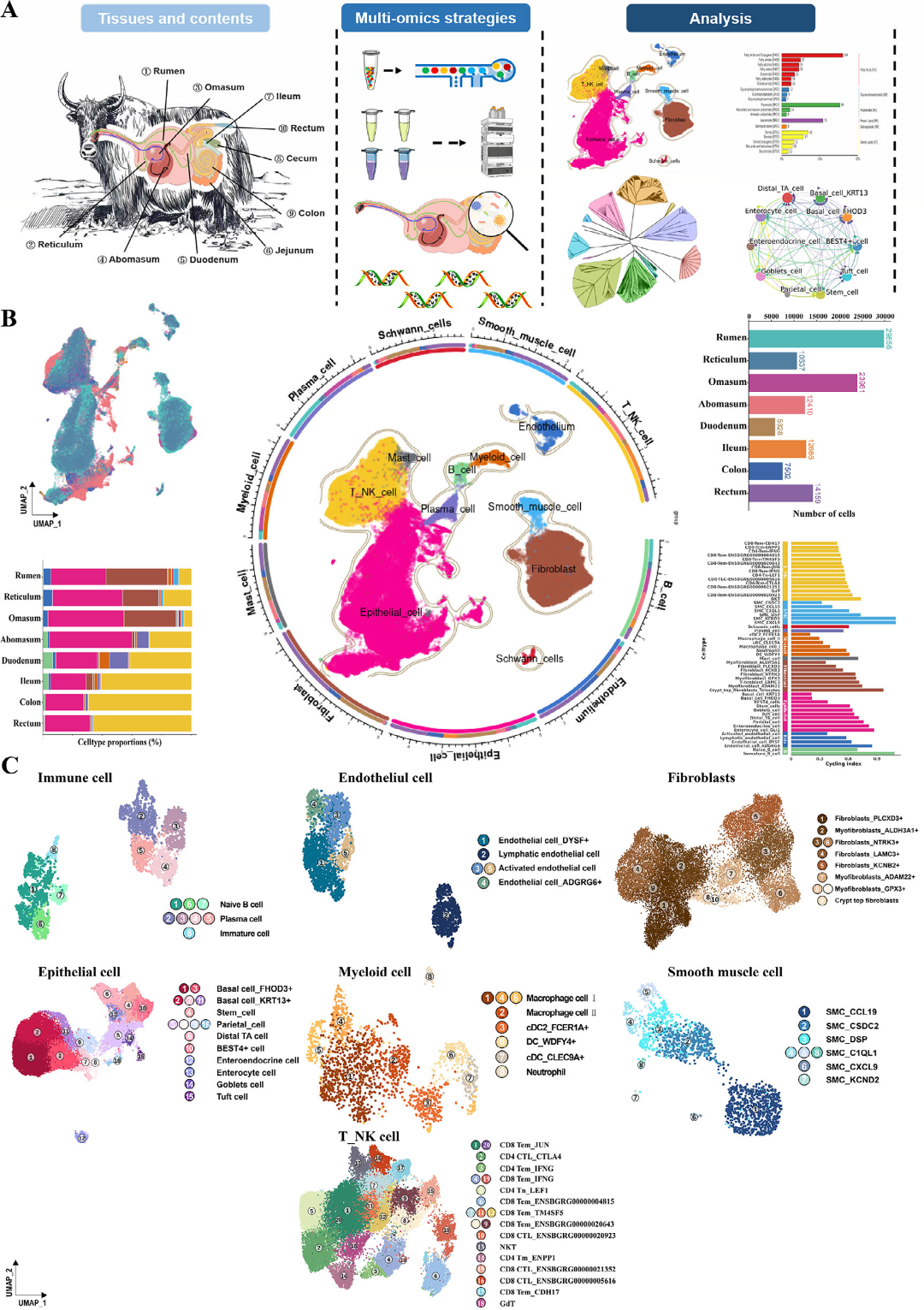
图1:牦牛胃肠道单细胞转录组图谱概览
二、牦牛GIT组织特异性表达模式
通过hdWGCNA(高维加权基因共表达网络分析)鉴定出8个与特定组织相关的基因模块,例如黄色和蓝色模块富集于前胃,粉色模块富集于回肠。
分析转录因子(transcription factor, TF)活性,鉴定出61个组织特异性TF。其中,HNF4A在前胃活性最高,SREBF2在肠道活性显著。HNF4A靶基因参与能量代谢(如Acat1、ACSL5、PGC-1α)和短链脂肪酸(short-chain fatty acids, SCFAs)转运;SREBF2靶基因则涉及脂肪酸运输(FABP6)、胆汁酸代谢(SLC10A2)和葡萄糖转运(SLC2A2)。KEGG通路分析表明,这两个TF共同激活了葡萄糖和脂肪酸代谢及胰岛素信号通路(图2F)。
调控子模块分析揭示8个主要模块,其中模块3主要在肠道表达,模块4为胃特异性(图2H)。TF-TF网络显示不同模块间存在协同或组织特异性调控关系(图2I)。免疫组化验证HNF4A和SREBF2在胃、小肠和大肠均有表达(图2J)。
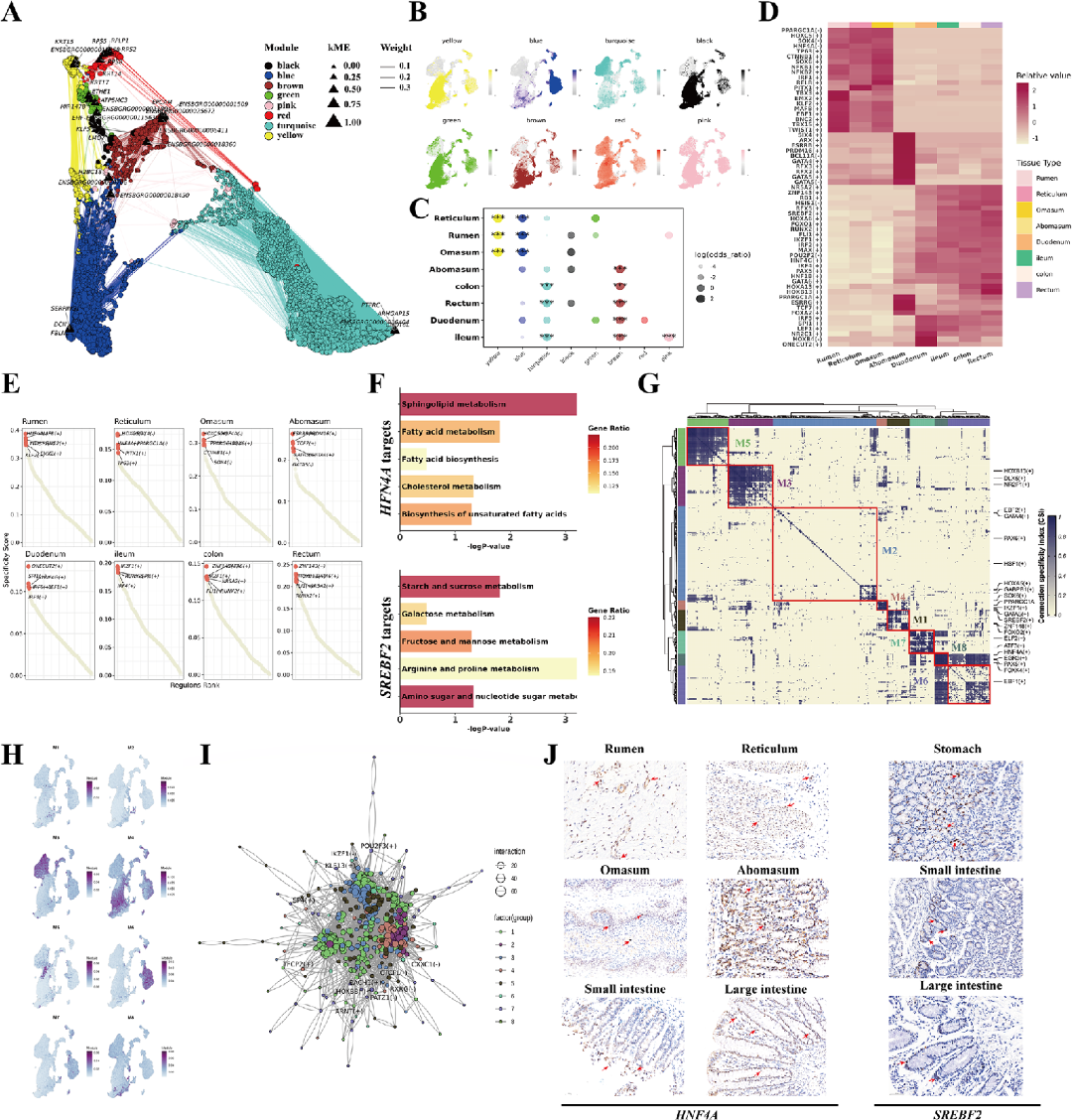
图2:不同组织间的分子特征与转录因子(transcription factor, TF)分析
三、跨物种比较分析揭示牦牛GIT转录特征
将牦牛数据与牛(cow)的单细胞数据进行跨物种比较,利用t-SNE和MetaNeighbor分析,发现免疫和髓系细胞的基因表达高度保守,而上皮细胞和成纤维细胞差异较大,反映了物种特异性功能(图3E)。
整合247头牦牛的全基因组关联研究(GWAS)数据,使用scPagwas方法发现,上皮细胞是唯一与体重性状显著相关的细胞类型(p < 0.01)(图3F),且具有最高的性状相关分数(trait correlation score, TRS),表明其在牦牛生长性能中的核心作用 (Figure 3G,H)。
对牦牛与牛上皮细胞的差异表达基因(differentially expressed genes, DEGs)分析发现,牦牛上皮细胞中上调基因富集于蛋白质调控、脂质代谢和上皮增殖等通路(Figure3I)。关键基因MYO6在牦牛中显著高表达,并通过免疫荧光染色验证为上皮细胞特异性标志物(Figure 3K)。
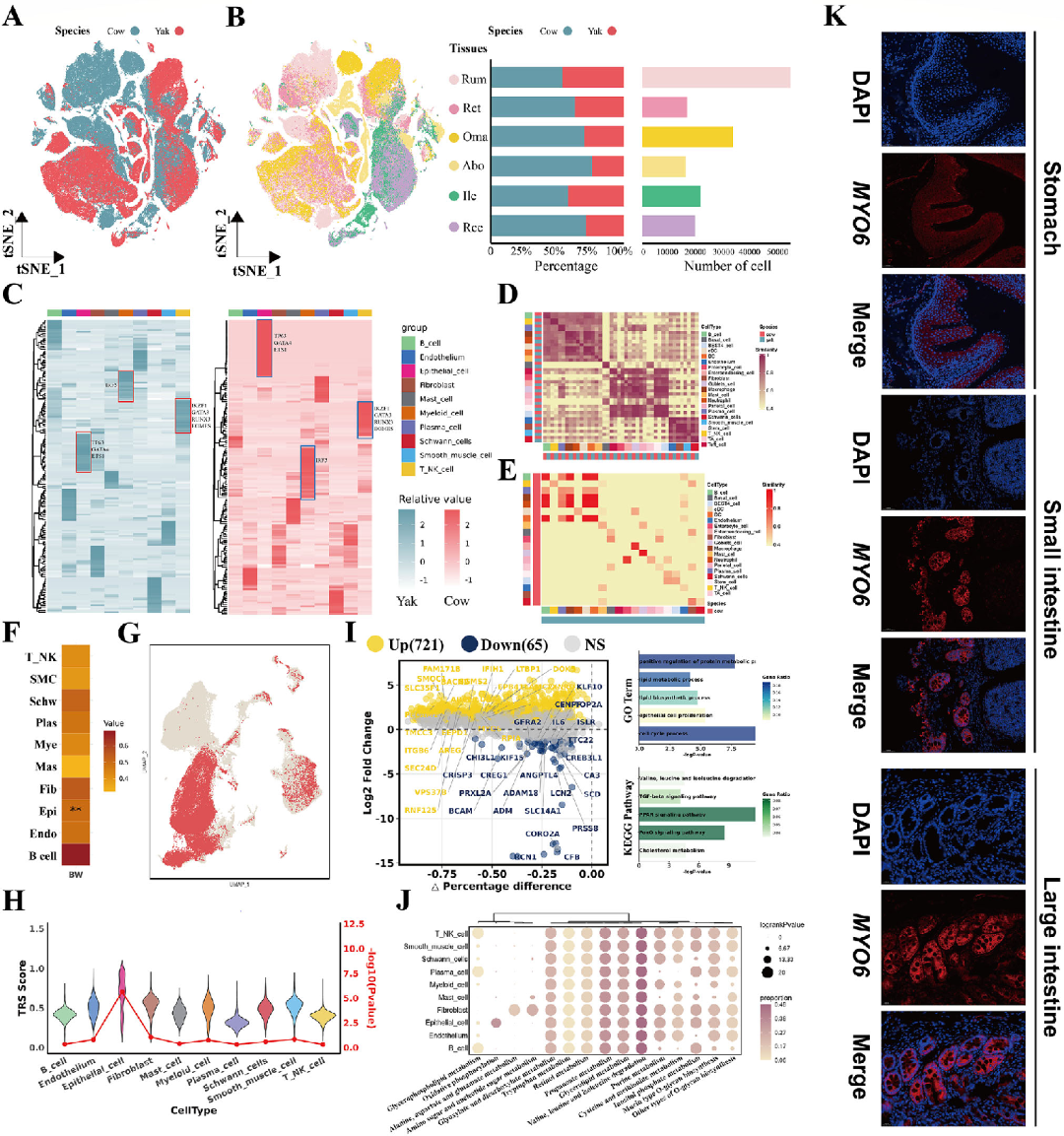
图3:跨物种细胞景观比较分析
四、牦牛胃肠道微生物组成、分类和功能的分析
通过宏基因组组装和分箱(metagenome assembly and binning)获得533个高质量的宏基因组组装基因组(MAGs),覆盖2个界、18个门 (图4B)。Bacteroidota和Firmicutes_A是优势菌门。PCoA分析显示,前胃、小肠和大肠的微生物群落明显分离(图4C)。微生物群的厚壁菌门/拟杆菌门(F/B)比值在小肠波动剧烈,表明其在营养吸收和能量获取中扮演关键角色。
利用SAHMI计算框架分析scRNA-seq数据,发现芽孢杆菌属(Bacillus)感染具有细胞类型特异性,主要发生在上皮细胞和T_NK细胞中,且其分布沿消化道呈现梯度变化,暗示其可能参与宿主的能量生产和免疫调节(图4E)。
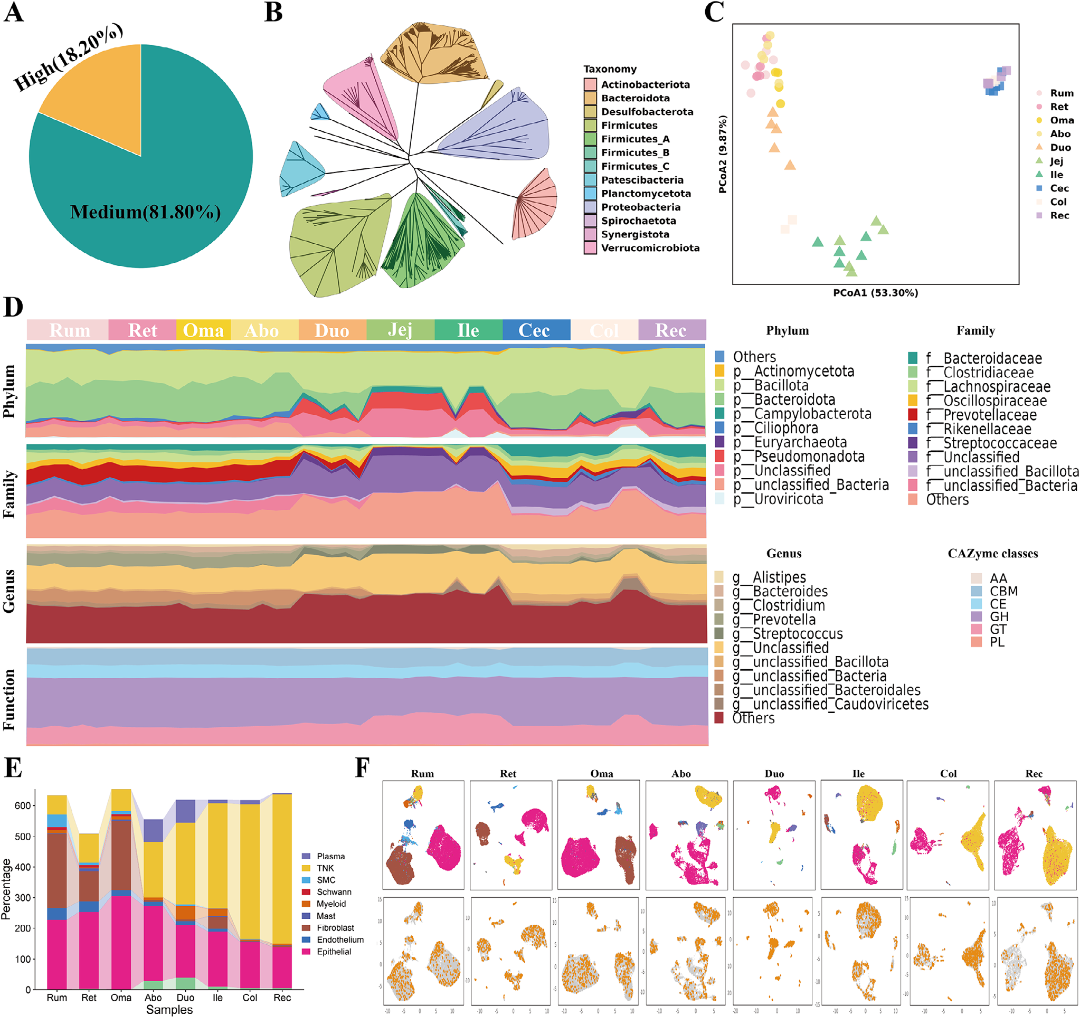
图4:基于宏基因组分析(MAGs)的牦牛胃肠道(GIT)各部位微生物特征概览
五、牦牛胃肠道不同组织的代谢特征
代谢组分析显示,大肠富含中等丰度代谢物,小肠则富含高丰度代谢物。高丰度代谢物以脂类和有机酸为主。PCA分析揭示了不同器官间独特的代谢特征(图5B)。胃部代谢物富集于核黄素代谢、酪氨酸代谢和脂肪酸合成通路;肠道代谢物则与氨基酸合成、三羧酸循环(TCA cycle)和脂肪酸降解相关 (图5D)。
WGCNA分析鉴定出与胃组织显著相关的“蓝色”代谢模块,并筛选出关键代谢物,如在瘤胃中富集的多不饱和脂肪酸——二十碳二烯酸(图5E,F)。小肠中L-苏氨酸和L-酪氨酸等氨基酸代谢物水平较高 (图5G)。这些结果表明牦牛GIT组织兼具功能共性和差异性,其代谢模式可能是适应高海拔环境的关键机制。
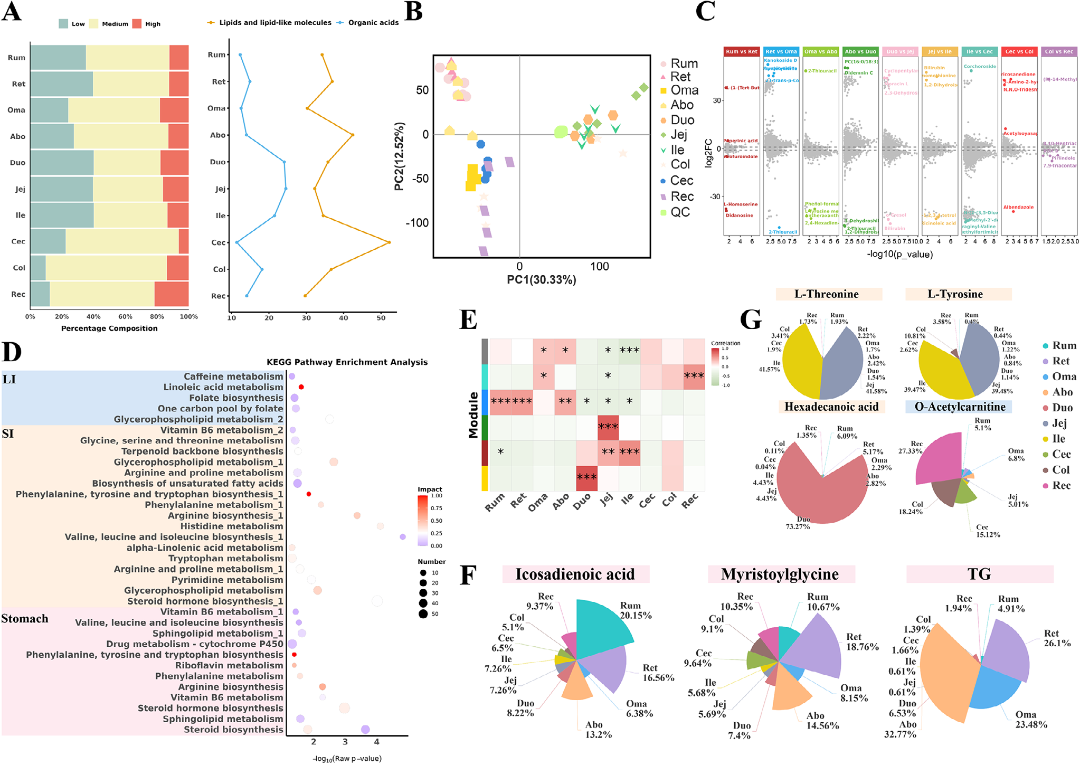
图5:牦牛胃肠道不同组织的代谢特征
六、不同组织中上皮细胞类型的代谢景观
细胞互作分析表明,上皮细胞是主要的信号接收者,而成纤维细胞是主要的信号发送者(图6A)。上皮细胞的代谢通路活性评分最高,尤其在丁酸盐代谢、TCA循环和脂肪酸延伸通路中富集(图6B)。
单细胞通量估计分析(scFEA)显示,杯状细胞(goblet cells, GCs)倾向于将葡萄糖转化为糖原储存;壁细胞(Parietal cell, PCs)则表现出更高的丙酮酸向乳酸转化的通量(图6C)。
代谢物传感器通信分析发现,不饱和脂肪酸是上皮细胞代谢互作的重要信号分子,SLC基因家族(特别是SLC27A5)作为关键传感器发挥重要作用(图6F)。
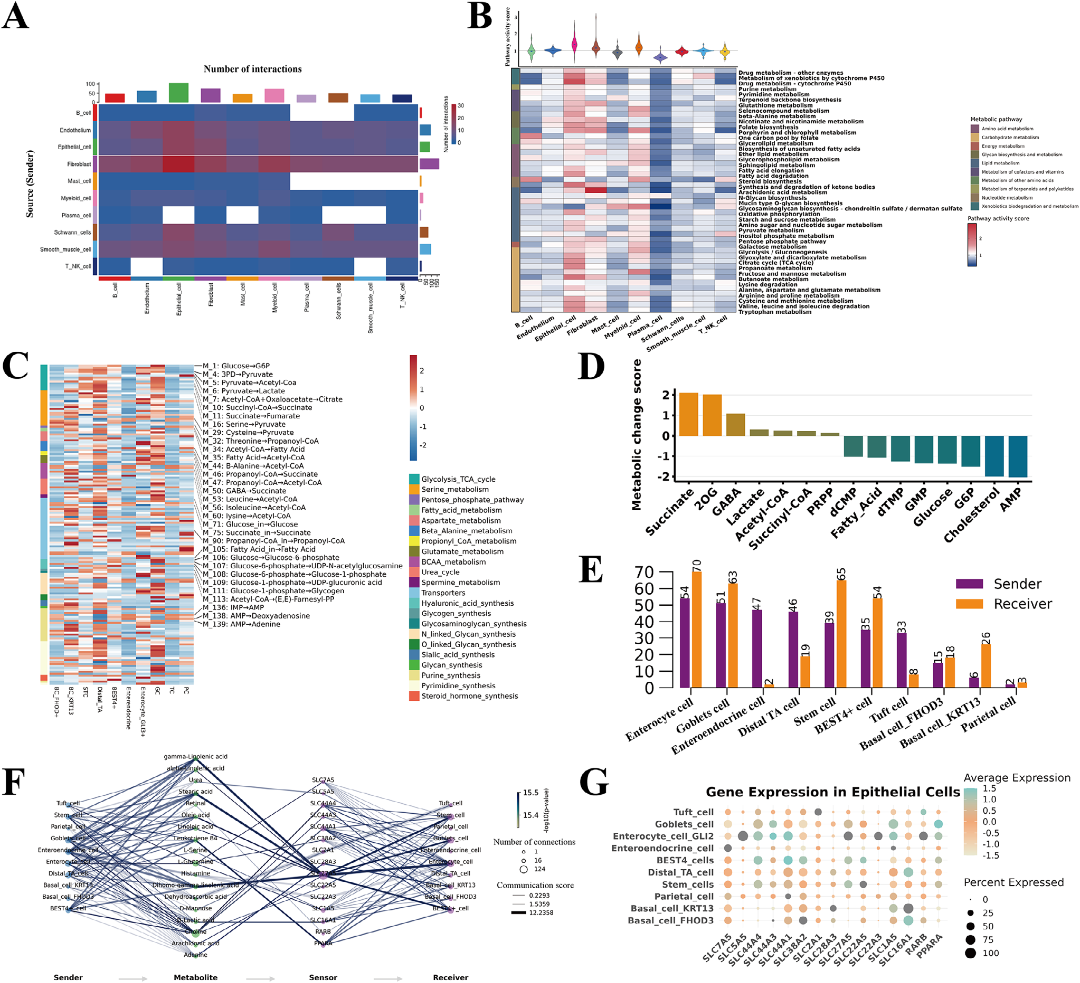
图6:上皮细胞代谢特征概览
七、参与牦牛营养吸收与能量代谢的微生物、代谢物和上皮细胞模式
综合所有组学数据,提出一个整合模型:在高海拔环境下,由HNF4A和SREBF2调控的MYO6基因表达,促进上皮细胞的脂质转运和膜稳定性。空间特异性的芽孢杆菌(Bacillus)定植与上皮细胞的代谢活动相互作用,影响琥珀酸、丁酸和糖原的积累,从而增强糖酵解和TCA循环的灵活性。不同上皮亚型采取不同的能量策略:GCs通过糖原储存优化能量供应,PCs则通过增强乳酸生成实现应激条件下的无氧ATP产生。PPARα和SLC27A5等关键受体介导了宿主-微生物-代谢物的对话。
综上,牦牛GIT中独特的宿主-微生物-代谢物互作和转录调控赋予其灵活高效的能量供应策略,以满足高海拔寒冷环境中的适应性调整和高能量需求。
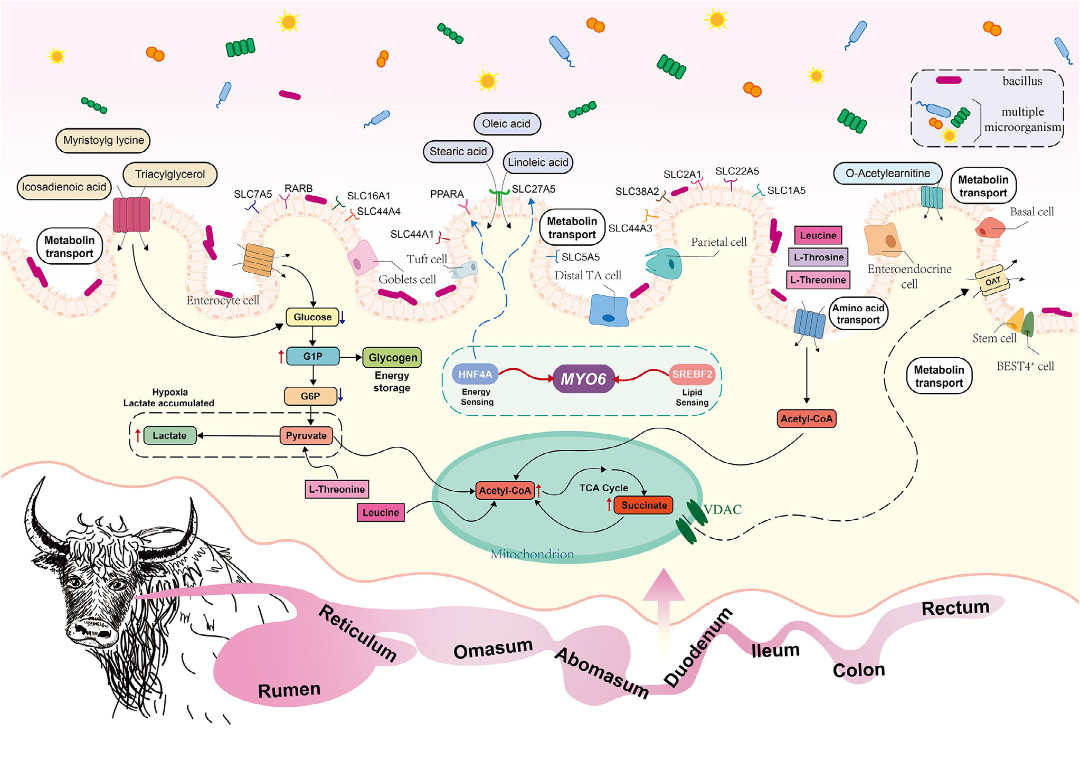
图7:牦牛胃肠道营养吸收与能量代谢的独特模式示意图
研究结论
本研究构建了牦牛首个全胃肠道单细胞图谱,结合多组学分析,系统揭示了其适应高海拔极端环境的能量代谢奥秘。鉴定出HNF4A和SREBF2为靶向关键基因MYO6的胃肠道特异性转录因子,揭示了牦牛胃肠道中独特的转录调控模式。同时,在对胃肠道内微生物和代谢物进行表征的基础上,发现重要微生物芽孢杆菌(Bacillus)感染具有细胞类型特异性,并通过不同上皮细胞代谢活动与微生物之间的互作以及各类细胞间的通讯(关键受体SLC27A5、PPARA),影响琥珀酸和乳酸等关键产物的积累,进而调节糖酵解和三羧酸循环等过程,增强牦牛胃肠道在极端环境下的适应能力。该研究为深入理解牦牛独特的胃肠道适应机制提供了新视角,对牦牛精准育种及哺乳动物胃肠道低氧响应的研究具有重要意义。
参考文献:
Huang C, Zhang M, Zheng Q, Yu Q, Yang G, Ren W, Ma X, La Y, Bao P, Chu M, Guo X, Liang C, Yan P. The High-Altitude Adaptation Characteristics of Microbiota-Host Cross-Talk in Yak Gastrointestinal Track. Adv Sci (Weinh). 2025 Oct 27:e14862. doi: 10.1002/advs.202514862. Epub ahead of print. PMID: 41144742.






