2025年11月12日,中国科学院脑科学与智能技术卓越创新中心杜久林研究员团队在《Neuron》上发表了题为“Globally patterned locus coeruleus-norepinephrine neuron-pericyte coupling orchestrates brain-wide vascular dynamics“的论文,该项研究首次揭示了LC-NE神经元与周细胞之间存在全局模式化的耦合关系,并阐明了这一机制在全脑血管动力学调控中的核心作用。
研究以全脑透明的斑马鱼幼鱼为模型,结合单细胞转录组学、光 / 化学遗传学、全脑成像等技术,首次揭示蓝斑去甲肾上腺素能(LC-NE)神经元作为 “司令部”,通过直接释放去甲肾上腺素和胶质细胞中继的间接途径,与毛细血管及毛细血管前小动脉周细胞形成全局模式化耦合,在局部神经血管耦合基础上介导全脑范围血管收缩,实现脑血流的全局调配与血管网络快速重置,从而高效满足大脑代谢需求。

发表期刊:Neuron
影响因子:15
涉及的欧易生物服务产品:单细胞转录组测序
研究背景
大脑是人体代谢最活跃的器官,仅占体重2%却消耗约20%的血氧,需要及时且精确的血流调控来匹配神经元活动的能量需求。传统上,神经血管耦合 (Neurovascular Coupling, NVC) 研究聚焦于局部层面——当神经元活动增强时,局部血管舒张、血流量增加,这一机制已被广泛研究并阐明。然而,随着全脑成像技术的发展,研究者发现即使简单的感觉刺激也能引起广泛的全脑神经元活动变化,这提示大脑必然存在全局血流调节机制,以协调有限资源在不同脑区间的优化分配。
蓝斑 - 去甲肾上腺素 (Locus Coeruleus-Norepinephrine, LC-NE) 系统作为大脑 "觉醒中枢",通过广泛的轴突投射支配整个中枢神经系统,在注意力、认知和应激反应中扮演关键角色。与此同时,周细胞 (Pericytes) 作为毛细血管壁上的收缩细胞,环绕毛细血管约 90% 的表面积,是调节局部脑血流和血脑屏障功能的关键效应器。
然而,长期以来,这两个重要系统如何协同调控全脑血管动力学的机制尚不清楚。杜久林团队在 2025年11月《Neuron》发表的研究,首次揭示了LC-NE神经元与周细胞之间存在全局模式化的耦合关系,并阐明了这一机制在全脑血管动力学调控中的核心作用。
技术路线

研究内容
该研究以全脑透明的斑马鱼幼鱼为模型,结合全脑在体成像、光 / 化学遗传学、药理学干预等技术,发现蓝斑去甲肾上腺素能(LC-NE)神经元作为全脑血流调控 “司令部”,通过直接释放去甲肾上腺素和经放射状胶质细胞中继的间接途径,与毛细血管及毛细血管前小动脉周细胞形成全局模式化耦合,在局部神经血管耦合基础上引发相对延迟的全脑范围血管收缩,既加速全脑血管网络重置,又通过优化脑区间血流调配增强局部血流变化,最终实现有限资源的高效分配以满足大脑代谢需求。这一发现从根本上拓展了我们对大脑如何协调血流与神经活动以支持认知功能的理解。
研究结果
1. 周细胞的分类、形态特征与全局激活模式
1) 周细胞的精准分类与形态学定义
基于转基因斑马鱼品系(Tg (fli1a:DsRedEx);Ki (pdgfrb:GAL4-VP16);Tg (4xnrUAS:GFP)),以血管分布区域为标准,将周细胞分为毛细血管周细胞(CPs) 和小动脉端周细胞(AEPs)。以中央动脉(CtAs)为起点,按血管分支数量划分 1–4 级及≥5 级血管,CPs 多分布于≥5 级高级别血管,AEPs 集中于低级别血管;周细胞呈现包裹型、网状或细丝状形态,与哺乳动物周细胞特征高度保守,且不同形态亚型呈空间分区分布。
2) 刺激与自发状态下的 “毛细血管→小动脉”(C-to-A)激活模式
a. 双重响应特征:伤害性刺激(optovin 激活 TRPA1)和视觉刺激(模拟捕食者接近)均诱导周细胞产生两类响应 —— 局部化“下降相”响应(与局部神经血管耦合NVC相关)和全脑广泛“上升相”响应(全局调控过程)。
b. C-to-A核心模式:上升相响应从侧方CPs启动,逐步向中央AEPs扩散;定量分析显示,CPs的上升相响应比例更高、半峰潜伏期更短(响应更快),AEPs的下降相响应比例更高,且响应速度随血管级别降低而减慢。
c. 自发活动验证:小幅度自发事件仅激活高级别CPs,大幅度事件同时招募高低级别周细胞,且CPs半峰潜伏期始终短于同事件中的AEPs;非麻痹幼鱼中该模式保持一致,排除药物干扰。

图1 周细胞群体在全脑血管系统中呈现从毛细血管到小动脉(C-to-A)的模式化活动
2. LC-NE神经元是周细胞全局激活的核心上游调控者
1) 排除局部神经元的主要驱动作用
同步成像实验(Ki (pdgfrb:GAL4-VP16);Tg (UAS:GCaMP6s);Tg (HuC:H2B-GCaMP6f) 品系)显示,感觉刺激下周细胞与相邻 5–60 μm 范围内神经元的活性强度存在空间错配,线性回归分析证实两者相关性极低(R² 值显著偏低),说明局部神经元并非全局周细胞激活的主要来源。
2) LC-NE神经元与周细胞的强度依赖性耦合
a. 候选靶点筛选:全脑神经元活性映射发现,激活最显著的集群集中于LC及周围区域,提示 LC-NE神经元的调控作用;神经支配分析显示,LC-NE 神经元轴突在全脑血管周围广泛分支,是脑血管区域NE能轴突的主要来源。
b. 时间与强度关联:绝大多数自发全局周细胞事件由LC-NE神经元事件触发,平均潜伏期5.4 ± 0.6 s;周细胞事件的规模(激活比例)和振幅与前置 LC-NE 神经元事件强度呈正相关——中等强度LC-NE事件仅激活CPs,高强度事件同时招募CPs和AEPs,与C-to-A模式完全契合。
c. 刺激验证:伤害性刺激和视觉刺激下,周细胞事件均紧随LC-NE神经元事件发生,潜伏期分别为6.9 ± 0.6 s和2.9 ± 0.9 s,证实刺激诱导的全局激活依赖LC-NE神经元。
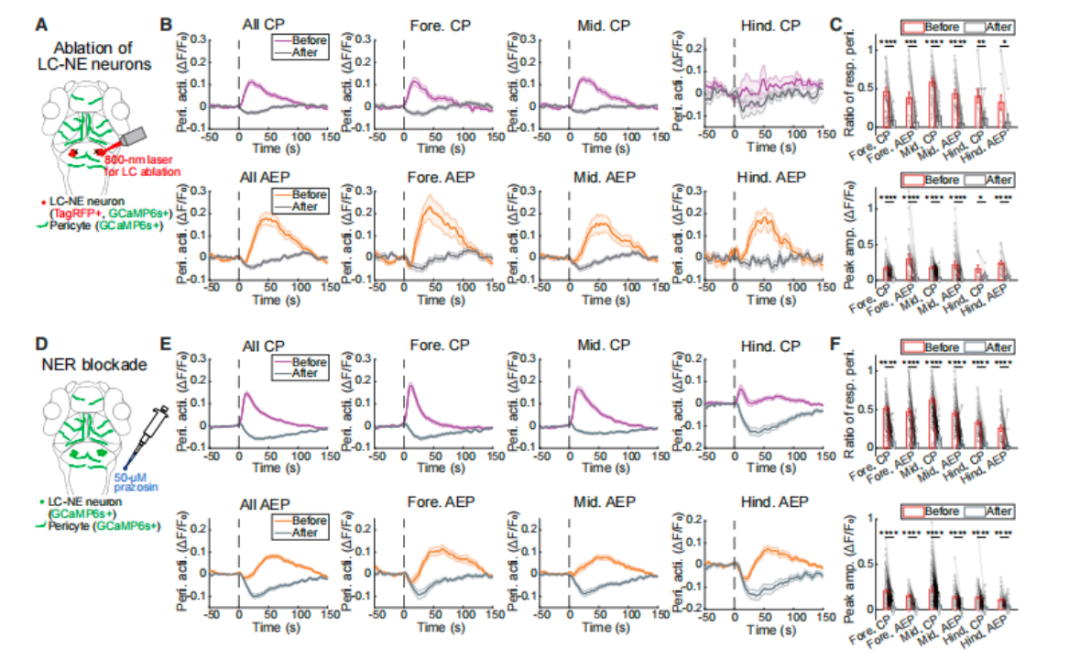
图2 LC-NE神经元是感觉诱发的周细胞全局活动所必需的
3. LC-NE神经元调控周细胞与血管收缩的功能验证
1) LC-NE神经元的必要性验证
a. 神经元消融实验:双光子靶向消融LC-NE神经元后,伤害性刺激诱导的周细胞上升相响应显著减弱,CPs和AEPs的响应比例、峰值振幅均大幅下降,而下降相响应(NVC 相关)因全局收缩驱动解除而增强。
b. 受体阻断实验:使用NE受体(NER)广谱拮抗剂哌唑嗪(50 μM)阻断NE信号,周细胞上升相响应被完全抑制,证实NE是LC-NE神经元调控周细胞的关键介质。
2) LC-NE神经元激活的直接效应
a. 光遗传学激活:Tg (dbh:GAL4FF,UAS:ChrimsonR-tdTomato) 品系中,561nm激光刺激LC-NE神经元,可触发全脑周细胞C-to-A模式激活,潜伏期2.1 ± 0.3 s。
b. 化学遗传学激活:Tg (dbh:tetoff-TRPV1-TagRFP) 品系中,局部puff辣椒素激活LC-NE神经元,同样诱导周细胞C-to-A模式激活,潜伏期2.3 ± 0.2 s。
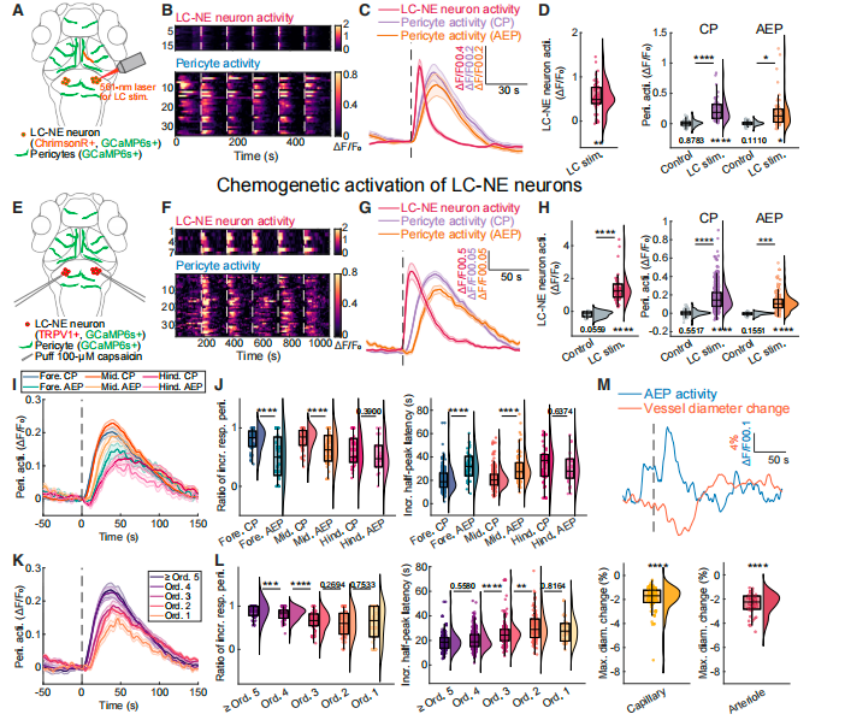
图3 LC-NE神经元可诱导周细胞的全局模式化活动及血管收缩
4. 双通路调控机制:直接通路与放射状胶质细胞中继间接通路
1) 直接通路:NE→CPs α2 - 肾上腺素受体(α2-AR)
a. 分子基础:单细胞转录组测序验证,CPs高表达α2-AR;药理学实验显示,特异性阻断 α2-AR可完全抑制CPs 的上升相响应,而对AEPs响应无显著影响。
b. 调控特征:LC-NE神经元直接释放NE,结合CPs表面α2-AR,快速触发CPs收缩(秒级响应),主要调控毛细血管水平血流阻力。
2) 间接通路:NE→放射状胶质细胞(RG)→AEPs
a. 信号传递链:LC-NE神经元释放的NE先激活放射状胶质细胞,诱导其释放ATP;ATP结合AEPs表面P2Y受体,引发AEPs钙信号升高并收缩。
b. 调控特征:响应延迟(10-30秒)、扩散性强,主要调控小动脉端血管张力,与直接通路形成功能互补。
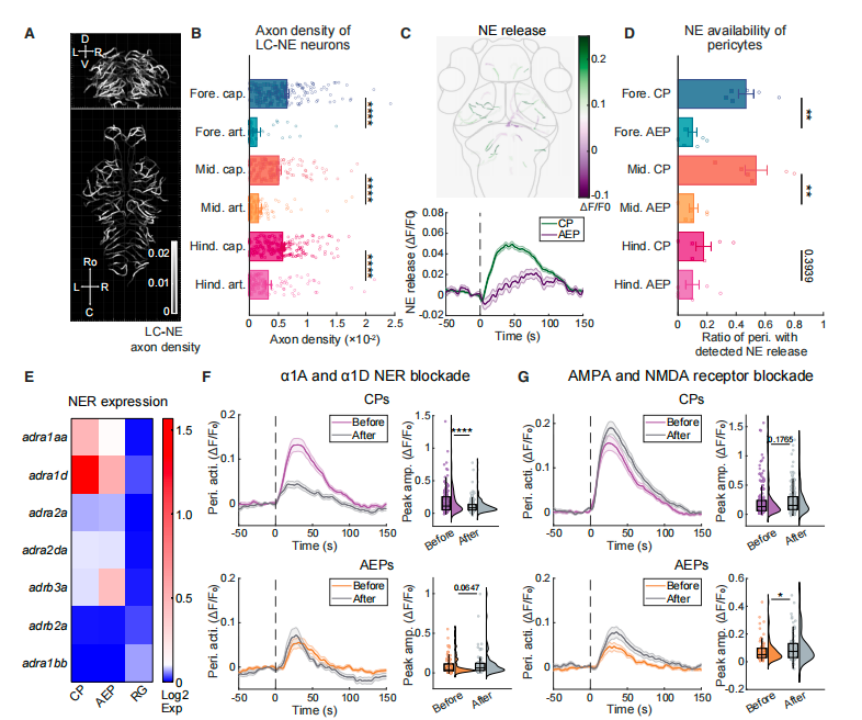
图4 LC-NE神经元优先通过直接通路和间接通路向毛细血管周细胞(CPs)和小动脉末端周细胞(AEPs)传递信号
5. 全脑血管动力学调控效应与生理功能
1) 血管与血流的模式化变化
a. 血管收缩效应:LC-NE神经元激活后,全脑血管呈现“毛细血管→小动脉”梯度收缩,CPs所在的高级别血管收缩幅度(直径减少12%-18%)显著大于AEPs所在的低级别血管(直径减少5%-8%)。
b. 血流优化分配:全局收缩不降低局部NVC介导的血流响应幅度,反而通过“全局重置”减少无关脑区血流,增强任务相关脑区的血流占比,实现有限资源的高效分配。
2) 与觉醒状态的功能对齐
该调控机制使全脑血管状态与LC-NE系统介导的觉醒状态同步:觉醒度升高(如应激、注意力集中)时, LC-NE神经元活性增强,通过双通路驱动全脑血管模式化收缩,为持续行为表现提供能量支持。
研究结论
该研究明确蓝斑去甲肾上腺素能(LC-NE)神经元作为全脑血流调控核心,通过释放去甲肾上腺素的直接途径与放射状胶质细胞中继的间接途径,与毛细血管周细胞和小动脉端周细胞形成全局模式化耦合,驱动具有血管层级特异性的全脑周细胞激活与相对延迟的全局血管收缩,既加速脑血管网络重置,又协同局部神经血管耦合优化脑区间血流调配,填补了全脑尺度血流调控机制的知识空白,为理解大脑资源高效分配规律及相关神经退行性疾病、脑血管疾病的病理机制与治疗靶点开发提供了重要理论依据。
参考文献:
Sun L, Peng XL, Zi HX, Zhang ZK, Gong YC, Li J, Zhu YQ, Yang YQ, Cao HW, Hu D, Wang K, Du JL. Globally patterned locus coeruleus-norepinephrine neuron-pericyte coupling orchestrates brain-wide vascular dynamics. Neuron. 2025 Nov 12:S0896-6273(25)00791-3. doi: 10.1016/j.neuron.2025.10.010. Epub ahead of print. PMID: 41232533.






