2025年10月13日,复旦大学附属中山医院胸外科詹成教授团队,在国际顶级期刊Cancer Communications(IF24.9)上发表了题为”CD24 is a Promising Immunotherapeutic Target for Enhancing Efficacy of Third-Generation EGFR-TKIs on EGFR-mutated Lung Cancer“的研究论文,发现CD24可作为增敏第三代EGFR-TKIs疗效的关键免疫治疗靶点,其通过调控巨噬细胞吞噬作用和下游信号通路促进肿瘤耐药,对于解决肺癌患者EGFR-TKI耐药难题提供全新的治疗方向。

发表期刊:Cancer Communications
影响因子:24.9
涉及的欧易生物服务产品:转录组测序、单细胞核转录组测序
研究背景
表皮生长因子受体(EGFR)突变是肺癌最常见的驱动突变类型。目前,以奥希替尼为代表的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)已成为EGFR突变的肺癌患者的首选治疗方案,尽管第三代EGFR-TKI在治疗初期疗效显著,但多数患者在15至19个月内会因残留少量肿瘤细胞无法根除并最终导致耐药。目前,对于无法手术切除且携带EGFR敏感突变的肺癌患者,多种第三代EGFR-TKI一线治疗的中位无进展生存期仅有约20个月,这一现状突显了寻找能够与第三代EGFR-TKI协同增敏的新型治疗靶点的重要性。
研究内容
本研究基于转录组和单细胞转录组数据筛选可能与EGFR-TKI联用的有效治疗靶点,并利用临床肺癌样本的单细胞核转录组测序及各种体内外实验进行充分验证。通过CRISPR/Cas9及体外/内模型,评估CD24在EGFR-TKI治疗中对抗增殖与逃逸清除的影响,并测试CD24敲除或CD24抗体与EGFR-TKI联用的效果。进一步探究CD24的转录调控机制,鉴定关键转录因子,并通过免疫共沉淀与质谱、磷酸化蛋白质组学分析YY1 S247位磷酸化的功能,筛选调控该磷酸化的上游激酶,阐明其在CD24表达与TKI耐药中的作用,为克服EGFR-TKI耐药提供新策略。
研究结果
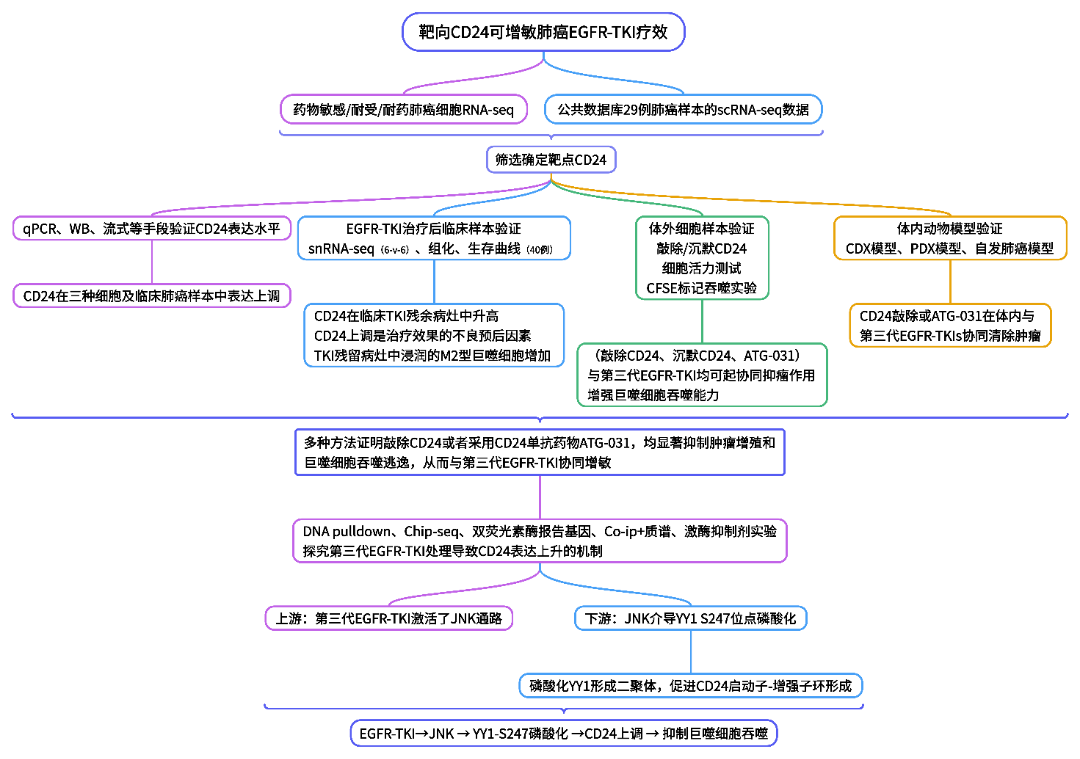
Result1 CD24在第三代EGFR-TKI耐药细胞、耐受细胞及药物响应细胞中普遍上调
作者首先通过将三种不同的EGFR突变肺癌细胞系(PC-9、HCC827和H1975)与最常用的第三代EGFR-TKIs(奥希替尼、阿美替尼、伏美替尼和贝福替尼)处理48 h,建立了EGFR-TKI响应细胞耐药模型(图1A、B)。为了确定基于抗体的治疗联合第三代EGFR-TKIs的潜在靶点,作者对奥希替尼敏感细胞、耐药细胞及其各自的亲本细胞进行了RNA-seq分析,并通过对RNA-seq的差异基因进行交集分析,共鉴别出11个在短期处理和耐药细胞中均显著上调的候选基因(图1C)。接着,作者进一步分析公共数据库中29例肺癌患者的单细胞测序数据,发现这11个候选基因中,CD24在肿瘤细胞中的表达特异性高于其它候选基因(图1D),因此,研究者选择CD24作为进一步的研究对象,并用 qPCR、WB、流式等方法评估了CD24的mRNA及蛋白表达水平(图1E~J),发现在EGFR突变肺癌细胞中,第三代EGFR-TKIs耐药进化过程中CD24表达上升。
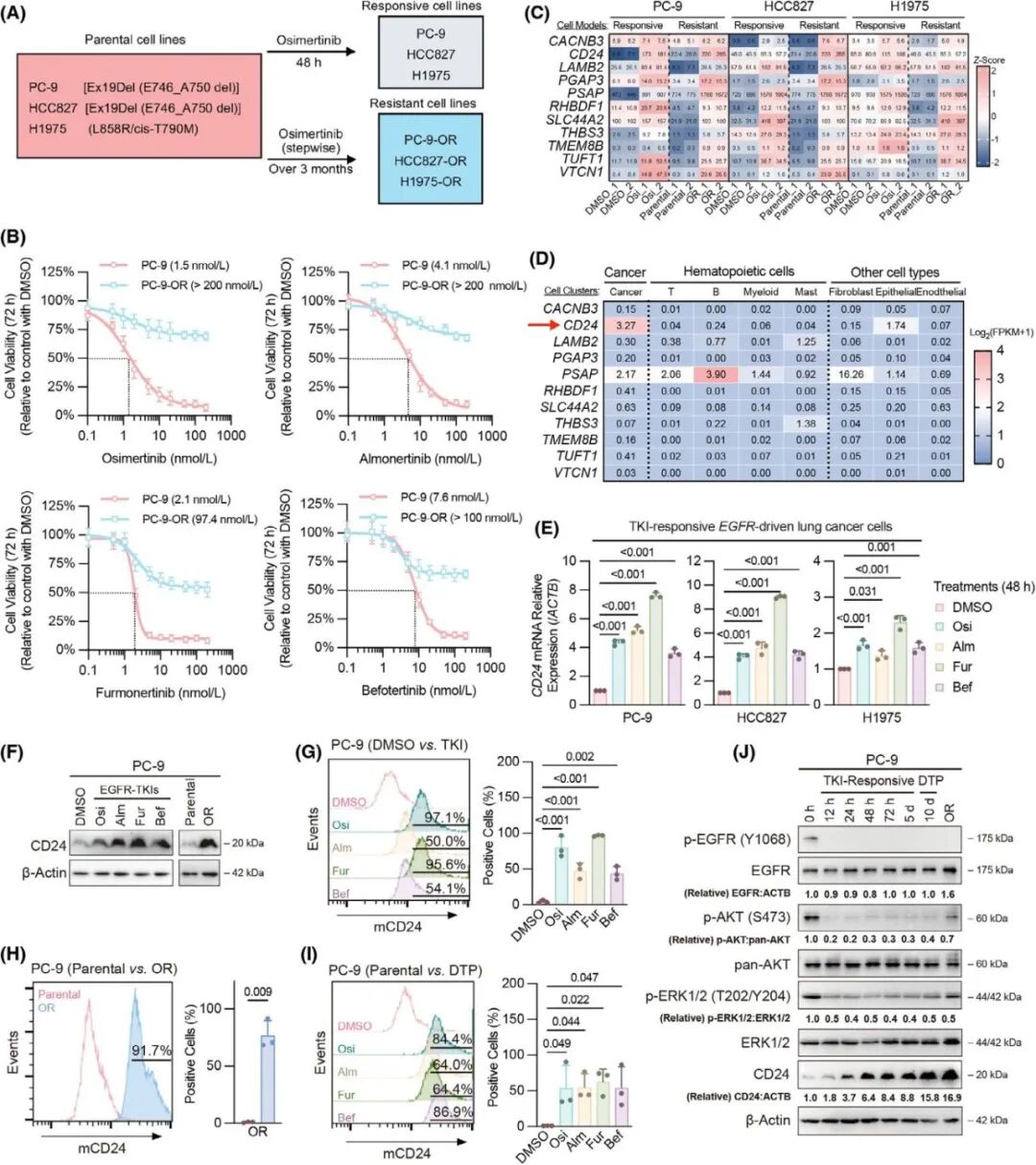
图1. CD24 在对第三代EGFR-TKI敏感、耐药和DTP肺癌细胞中均上调
Result 2 CD24在临床TKI残留病灶中升高并预示不良疗效
为了研究EGFR-TKI治疗后临床病例中CD24表达是否上调,作者用snRNA-seq技术继续分析了六名晚期EGFR突变肿瘤患者的标本:治疗前基线肿瘤和以及奥希替尼治疗后患者的残留肿瘤(图2A-D),结果表明,与未治疗的基线病灶相比,CD24的mRNA水平在TKI残留病灶中显著上调(图2E),在蛋白水平验证了CD24的表达与snRNA-Seq结果一致(图F、G)。40例术后接受第三代EGFR-TKI辅助治疗患者的生存曲线显示CD24蛋白高表达与较差的RFS显著相关(图2H)。这些结果表明,CD24在接受第三代EGFR-TKI治疗的患者肺癌组织中显著上升,并且其表达可作为第三代EGFR-TKIs疗效的不良预后因素。
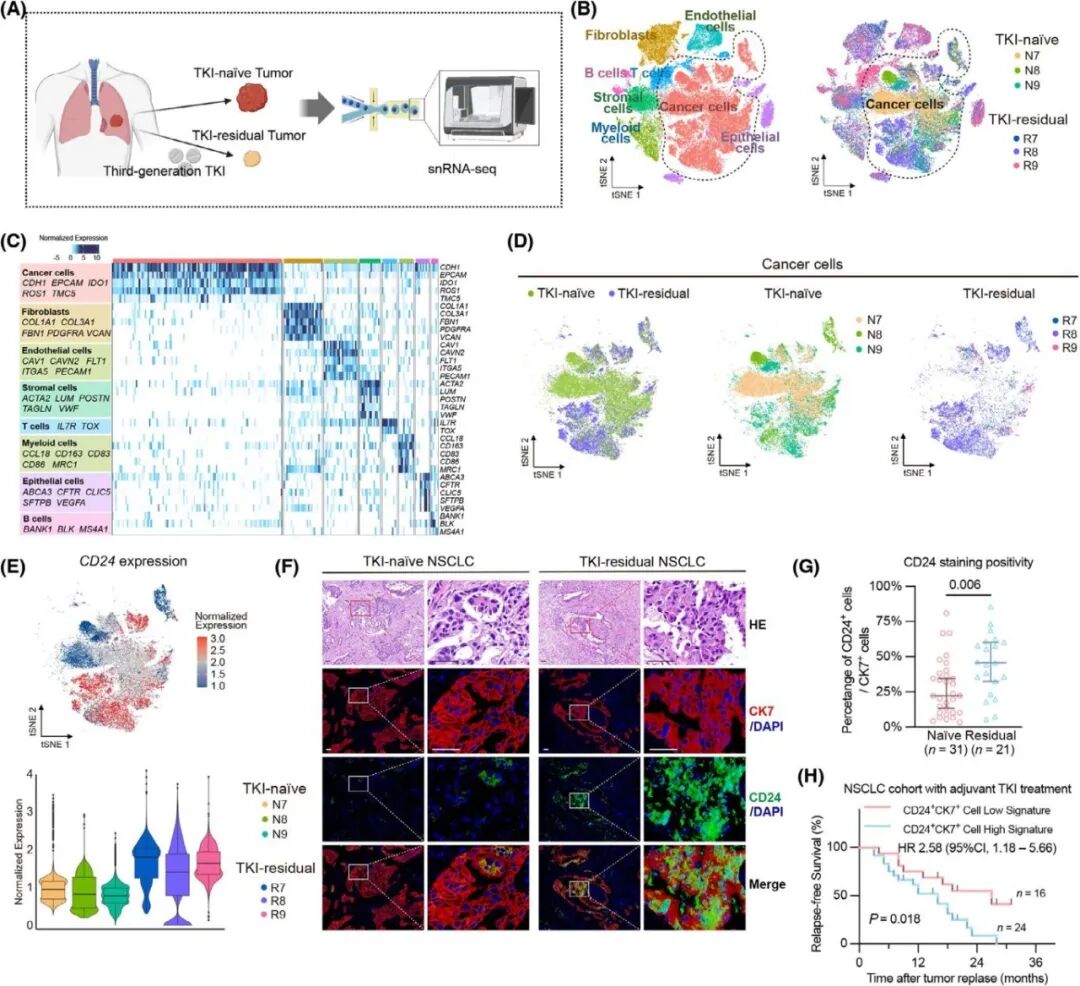
图2. CD24在临床TKI残余病灶中升高,并且是治疗效果的不良预后因素
Result 3 残留病灶中CD24表达升高是导致细胞增殖增强的原因
使用CRISPR/Cas9基因编辑技术敲除了EGFR突变细胞系中的CD24基因以在体外探究CD24对EGFR-TKI疗效的影响,细胞活力结果表明,敲除CD24显著降低了基线细胞增殖能力,并减少了PC-9、HCC827和H1975细胞在第三代EGFR-TKIs处理后的相对细胞活力(图 3A-C),通过测定存活细胞的比例以及抗性克隆生长的速度,作者观察到,敲除CD24导致肿瘤细胞增殖的初始减少持续60天,且在不同第三代EGFR-TKI治疗后持续增强,而在CD24基因敲除细胞中回补CD24则减弱了上述效果(图3D-E)。同时使用siRNA在耐药细胞中敲低了CD24表达进一步确定CD24在OR细胞中的表达水平(图3F)和增殖率均下降(图3G)。鉴于已有研究表明CD24调节EGFR下游存活通路,作者接下来用WB揭示敲除CD24敲除可降低由第三代EGFR-TKI抑制的AKT和ERK通路的活性,而沉默CD24则显著降低了AKT和ERK信号通路的活性(图3H)。
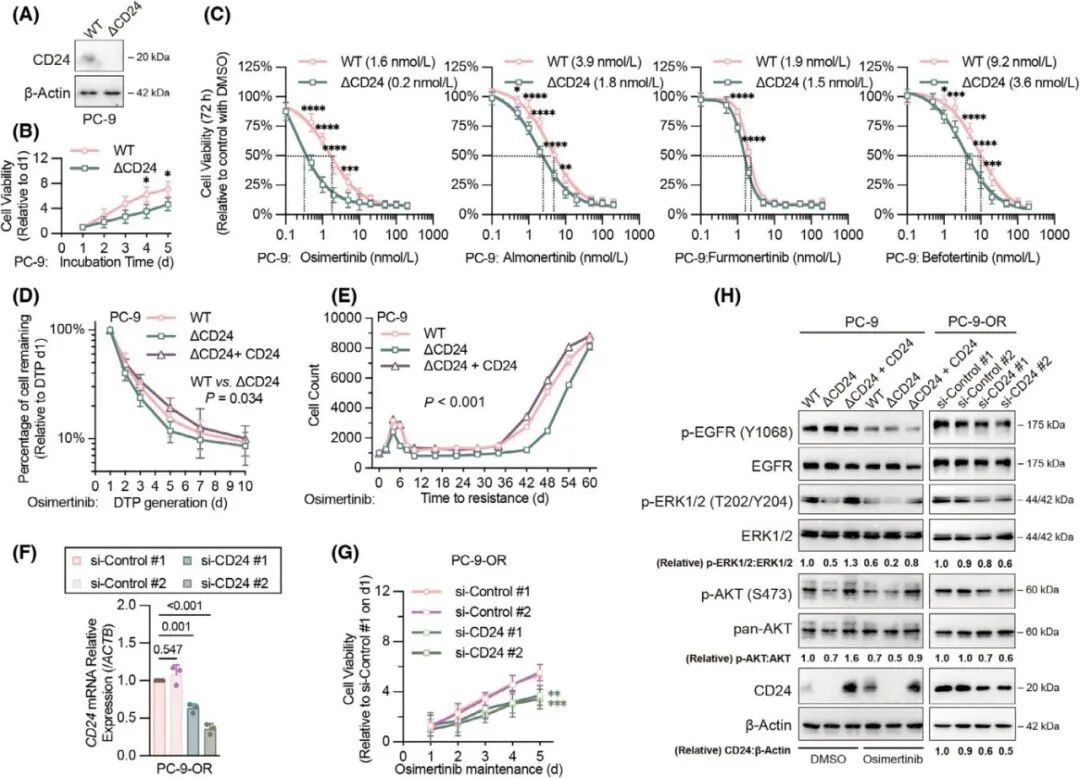
图3. 敲除或沉默CD24显著增强了第三代EGFR-TKIs在药物响应、DTP和耐药细胞中的疗效
Result 4 残留病灶中CD24上调表达是巨噬细胞介导的免疫逃逸的原因
由于CD24也作为一种抗吞噬检查点分子,作者接下来研究了CD24上调在第三代EGFR-TKIs治疗期间肿瘤免疫逃逸中的作用,观察到snRNA-Seq数据中TKI残留病灶的髓系细胞比例高于基线样本(图 4A-B),进一步通过M1和M2极化评分确定了极化的M2在TKI耐药样本中显著增加,而M1则没有显著变化(图 4C-D)。通过继续分析临床肺肿瘤标本和PC-9细胞系衍生的小鼠异种移植瘤中的巨噬细胞浸润和极化也证实了snRNA-seq的这些结果(图4E-J),表明在TKI治疗后,EGFR突变的肺癌标本中M2极化巨噬细胞的比例增加,而巨噬细胞可能通过CD24介导的方式促进肿瘤耐药性。
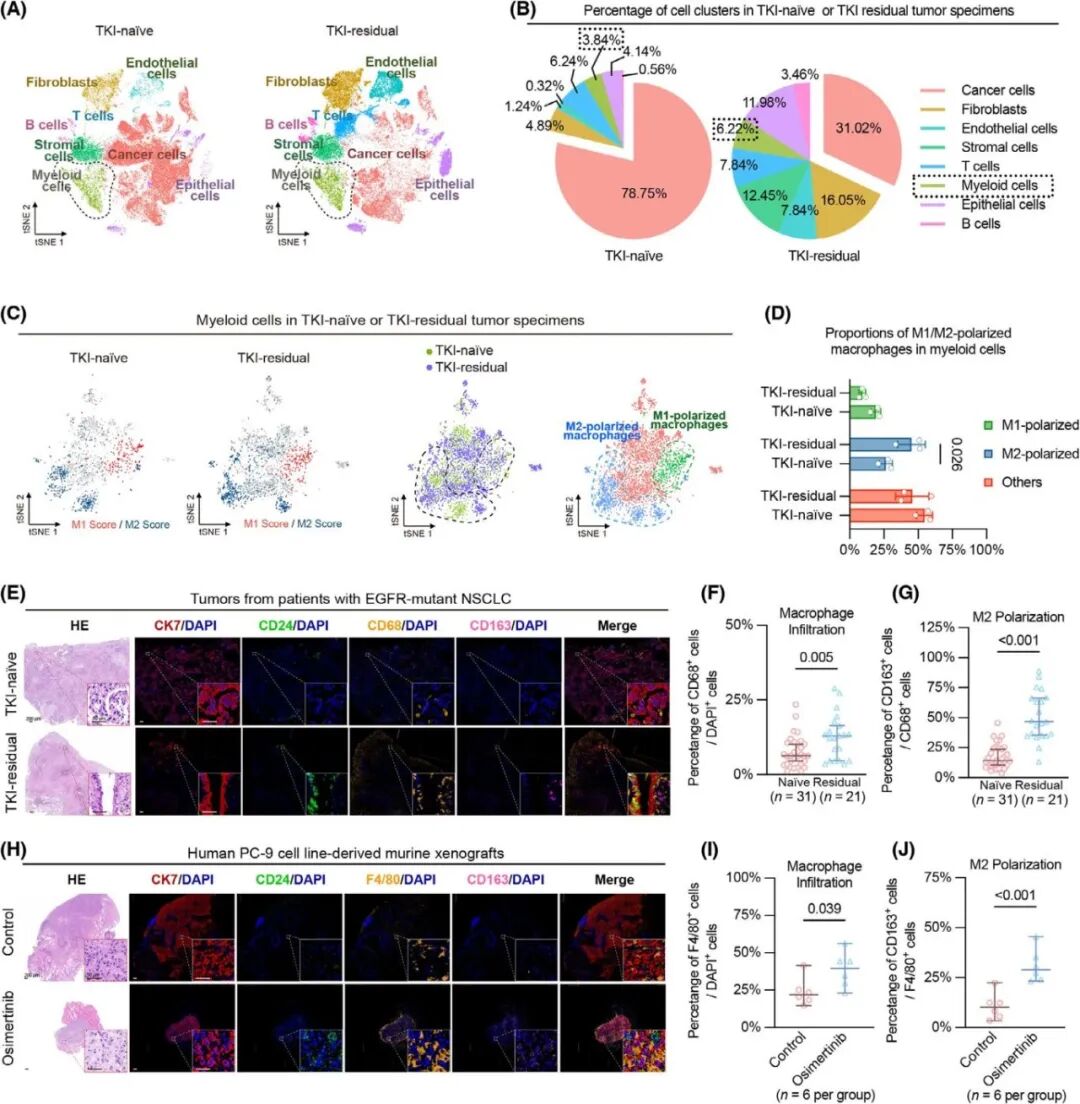
图4. 在TKI残留病灶中浸润的M2型巨噬细胞增加
Result 5 体外阻断CD24可增强巨噬细胞吞噬作用并与EGFR-TKI协同增敏
接着继续评估CD24表达在EGFR突变的肺癌细胞上对其抗吞噬能力的影响,snRNA-seq数据显示编码CD24的SIGLEC10基因主要在M2巨噬表达(图5A)。评估完THP-1细胞系适用于体外研究吞噬清除率后(图5B-D),进一步实验发现,OR细胞不如其亲本细胞容易被THP-1细胞系衍生的M2样巨噬细胞吞噬(图 5F),使用siRNA敲低CD24或用单克隆抗体ATG-031阻断CD24则可以消除这种效果(图5G-I),PC-9和H1975细胞中敲除CD24,或用ATG-031与第三代EGFR-TKIs联合处理均能显著增强巨噬细胞的吞噬能力。这些结果表明,针对CD24可能对第三代EGFR-TKIs耐药的肺癌有效。
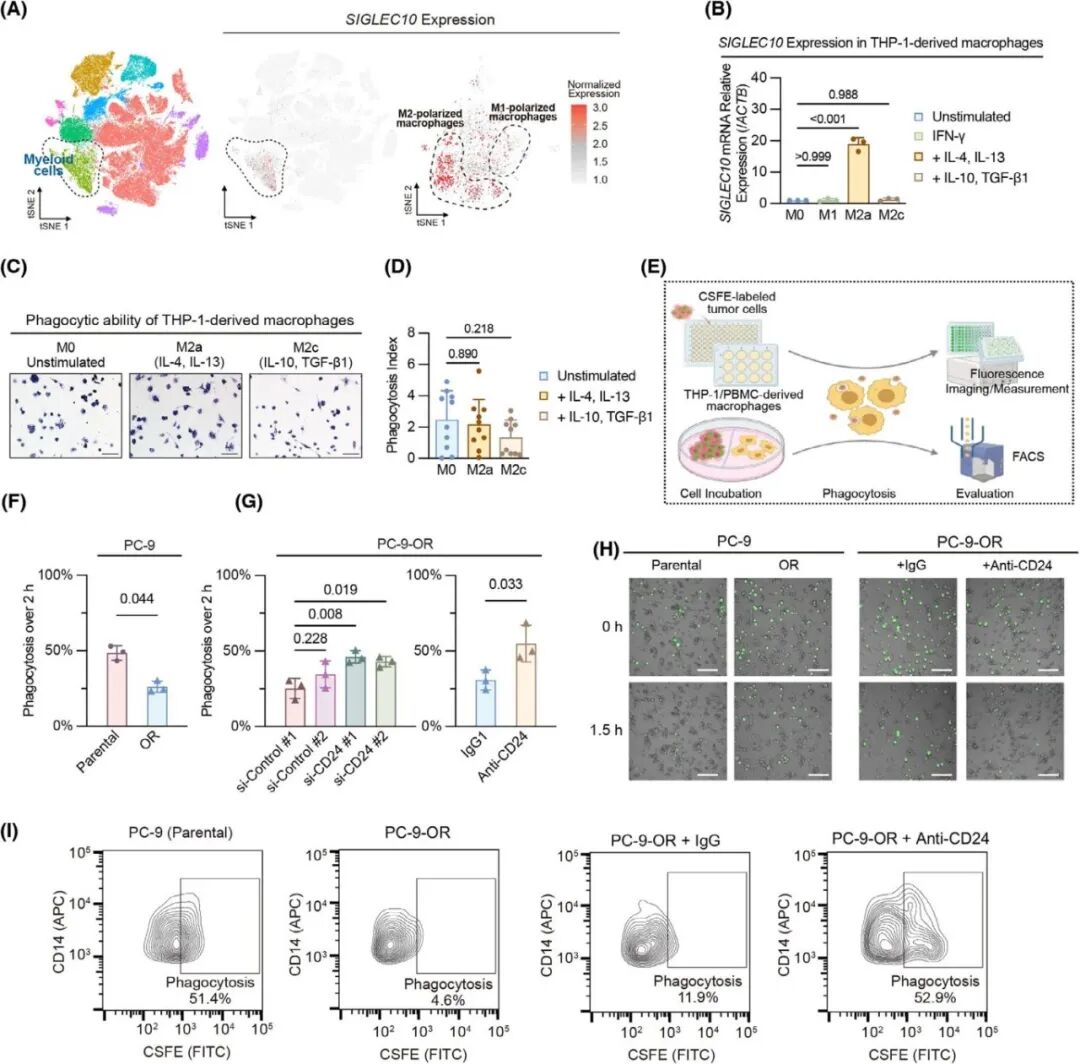
图5. 体外敲低CD24或使用ATG-031表现出与第三代EGFR-TKIs的协同作用
Result 6 敲除CD24或ATG-031与第三代 EGFR-TKIs 联用协同清除肿瘤
进一步用体内模型验证前面的发现,作者首先通过将表达CD24的野生型、ΔCD24以及表达荧光素酶的PC-9细胞皮下注射到裸鼠左侧腹股沟,建立了CDXs模型(图6A、B)。活体发光显示ΔCD24或ATG-031+奥希替尼可显著抑制肿瘤,巨噬清除可逆转协同效应(图C、D),使用Cre-LoxP技术表达人源化CD24的基因工程鼠肺癌模型的CT和生存曲线显示奥希替尼+ATG-031可显著延长生存并减少肿瘤负荷(图6E-G),表明使用ATG-031抗体阻断CD24与奥希替尼具有协同作用。3例术后残留PDX模型结果同样显示出与CDXs和自发性肺肿瘤中一致的观察结果,奥希替尼+ATG-031抗体的联合治疗可协同抑制肿瘤,CSF1R抗体耗竭巨噬后协同消失(图 6H-J),表明抗CD24治疗可能是促进EGFR突变肺肿瘤对第三代EGFR-TKIs的肿瘤反应的一种可行的联合策略。
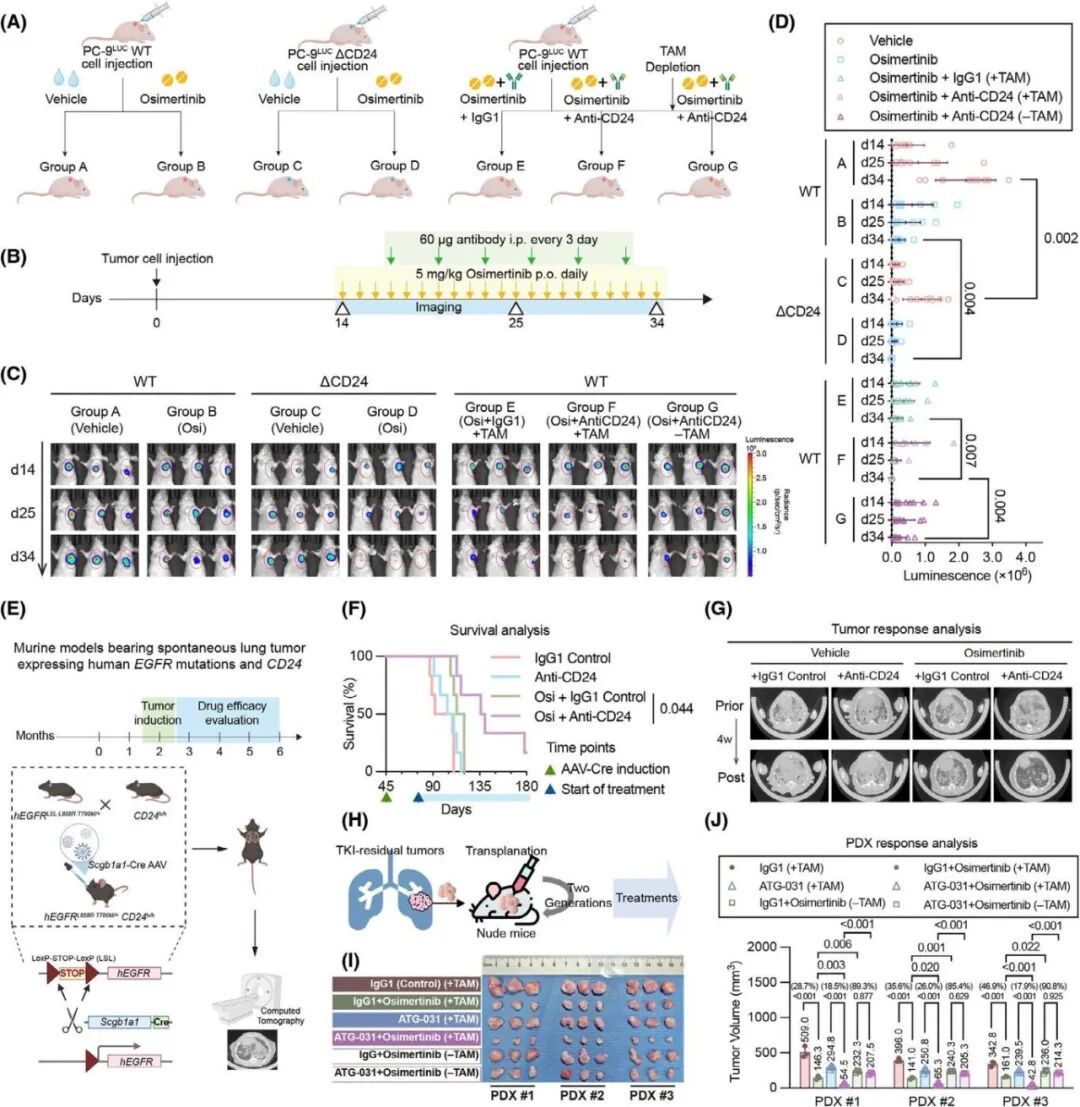
图6. CD24敲除或ATG-031在体内与第三代EGFR-TKIs协同清除肿瘤
Result 7 EGFR-TKI通过磷酸化YY1 S247位点上调CD24
为了研究第三代EGFR-TKI处理导致CD24表达上调的机制,作者采用DNA pull down联合质谱技术,并整合ENCODE数据库中的ChIP-seq数据发现具有结合峰的3个TF:MAX、YY1和ZNF143(图7A),其中YY1在三个TF中对CD24表达的影响最为显著。ChIP-qPCR实验显示,YY1在CD24启动子区域的招募同样显著(图 7C),随后用DNA pull down、双荧光素酶报告基因等实验证明YY1在EGFR突变的肺癌细胞中特异性结合并激活CD24基因表达(图 7D、E)。通过磷酸化组学进一步对YY1蛋白的Ser/Thr激酶进行磷酸化分析发现YY1的S247位点(YY1S247)在受到亲本细胞处理的OR细胞中显著上调(图 7F),在HCC827和H1975细胞系中验证了磷酸化YY1S247的水平(图7G),YY1S247A敲入显著降低了PC-9、HCC827和H1975细胞中CD24的表达,并消除EGFR-TKI处理后TKI诱导的CD24上调(图7H),表明YY1 S247位点的磷酸化是第三代EGFR-TKI处理后CD24上调的关键驱动因素。
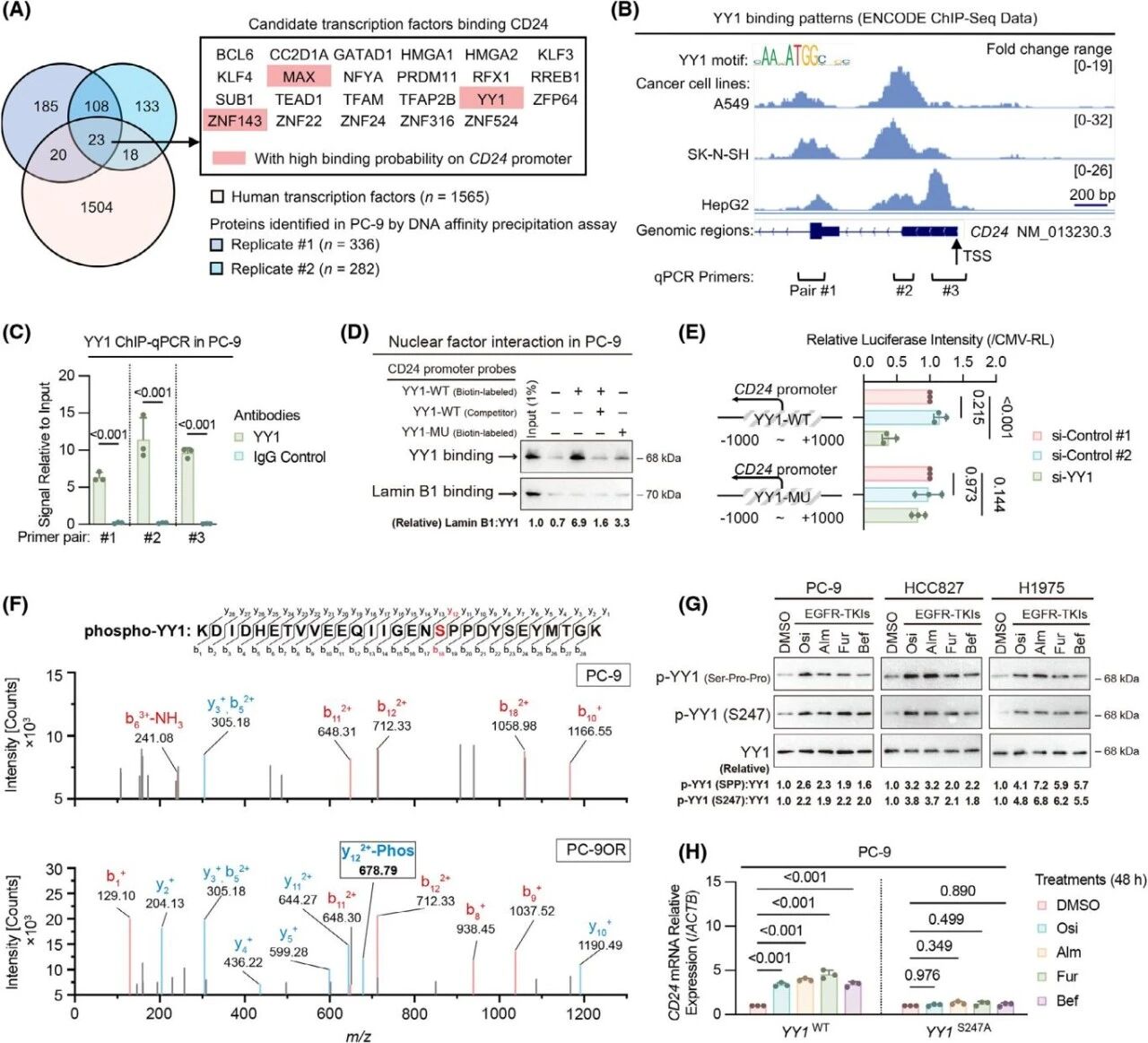
图7. 第三代EGFR-TKI通过磷酸化YY1 S247位点上调CD24
Result 8 EGFR-TKI诱导的磷酸化YY1S247参与了YY1二聚化
鉴于YY1 S247A突变可以抑制CD24基因表达,但不是通过直接抑制启动子的转录激活来发挥作用,接着作者继续探究S247A突变对CD24的间接影响,重新分析YY1在CD24基因座上的结合情况,发现在CD24转录起始位点上游4.1kb处发现了一个额外的YY1特异性结合峰富含基因增强子元件(图8A),使用ChIP-qPCR和DNA pulldown实验在EGFR突变的细胞系中验证了这一发现(图 8B)。AlphaFold2建模预测发现S247位于一个对同源二聚体稳定的螺旋界面内,这强烈支持其在二聚化中的结构作用(图8C),并通过构建WT、S247A突变体和ΔI242-S252截短YY1蛋白进一步解析了YY1二聚化的分子基础(图8D、E),表明YY1的S247位点在YY1二聚化中起着至关重要的作用,而第三代EGFR-TKI以YY1依赖的方式促进CD24基因的增强子-启动子环状结构。
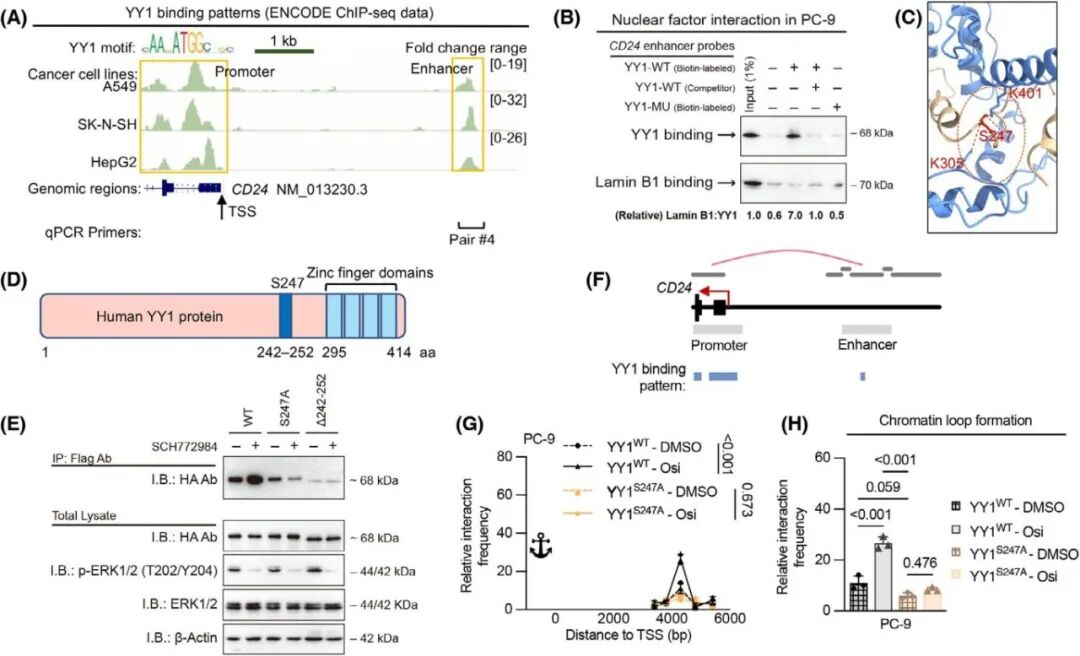
图8. 磷酸化YY1-S247促进YY1二聚化并介导CD24增强子-启动子环化
Result 9 EGFR-JNK-YY1-CD24 调节轴介导的对第三代 EGFR-TKIs 的耐药性
继续探究第三代EGFR-TKIs治疗下,磷酸化YY1S247位点的潜在上游激酶作用机制,发现五种激酶在耐药细胞中被激活 (图 9A),其中JNK抑制几乎完全消除了奥希替尼引起的CD24水平的增加(图 9B、C),表明JNK可以激活YY1S247的磷酸化,使得EGFR突变的肺癌细胞中高表达CD24。进一步实验证明敲低YY1或JNK抑制同样逆转了奥希替尼处理引起的CD24上调(图 9D-F),表明JNK通路促进了EGFR 突变肺癌中磷酸化YY1S247和CD24的表达,从而推动对第三代EGFR-TKIs耐药性的进化。
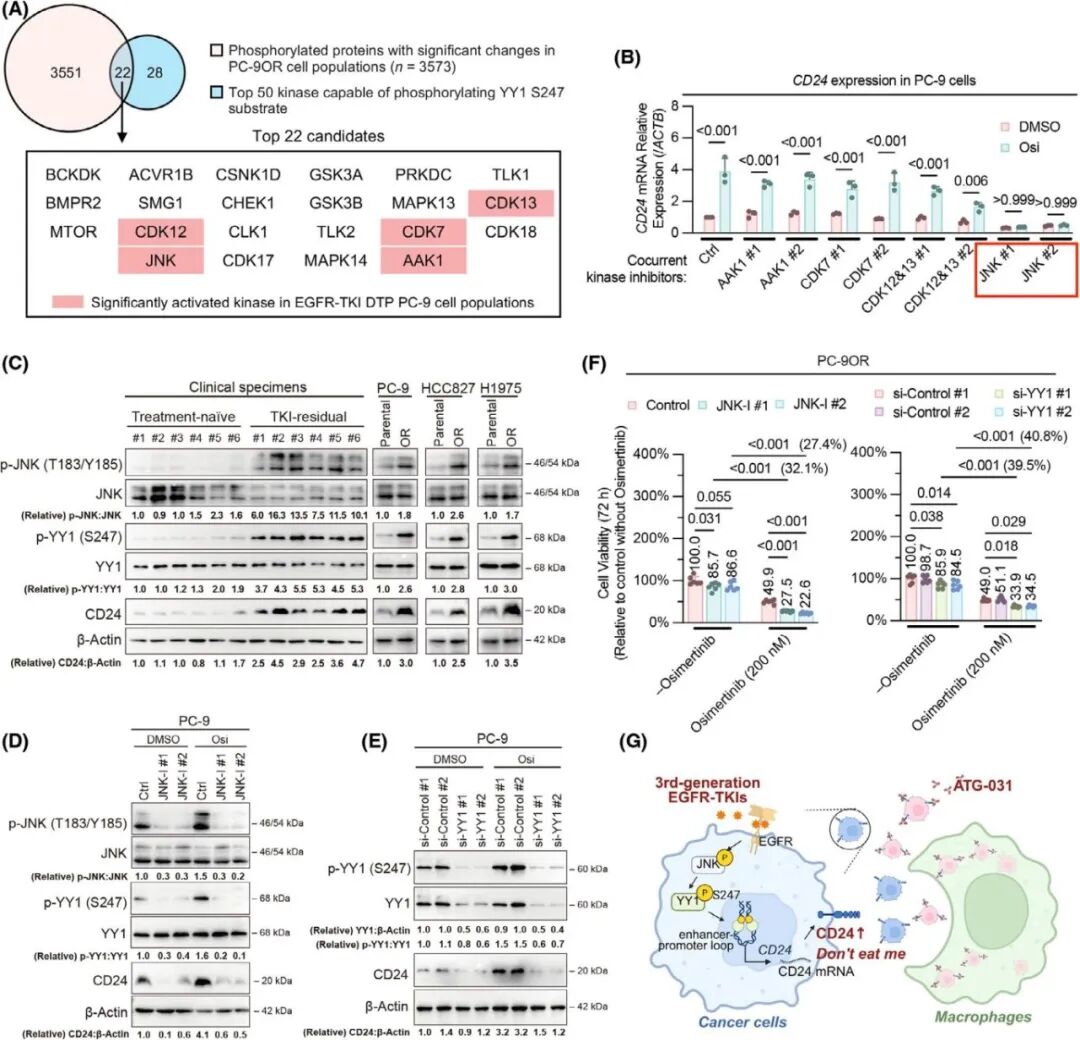
图 9. JNK-YY1轴抑制逆转CD24上调并恢复奥希替尼敏感性
研究结论
在对EGFR突变肺癌的研究中,本研究发现经过第三代EGFR-TKI治疗后,CD24表达显著增加是由JNK/phospho-YY1S247信号通路介导的结果,而CD24的显著上调则抑制了巨噬细胞的吞噬作用促进免疫逃逸,从而降低了这些EGFR-TKI治疗的治疗效果。敲除CD24或采用CD24单抗药物ATG-031,均能通过增加巨噬细胞对肿瘤细胞的增殖能力,从而实现与第三代EGFR-TKI协同增敏提升疗效,为EGFR突变肺癌联合治疗提供新策略。
参考文献:
https://doi.org/10.1002/cac2.70068






