前言
2025年11月18日,华中科技大学同济医学院基础医学院朱铃强/刘丹/鲁友明教授团队在Nature Neuroscience(IF=20)上发表题为“Spinal cord Tau pathology induces tactile deficits and cognitive impairment in Alzheimer’s disease via dysregulation of CCK neurons”的文章,该研究揭示了阿尔茨海默病(AD)早期脊髓中Tau病理的发展机制及其导致触觉缺陷的分子通路,明确了脊髓Tau病理在触觉功能障碍中的关键作用,为开发非侵入性早期诊断生物标志物及靶向治疗策略奠定了基础。欧易生物提供了该项目的单细胞核测序(snRNA-seq)服务。

发表期刊:Nature Neuroscience
影响因子:20
涉及的欧易生物服务产品:单细胞核测序(snRNA-seq)
研究背景
阿尔茨海默病(AD)作为一种进行性神经退行性疾病,患病率因人口老龄化而激增,但现有药物仅能部分延缓早期进展,凸显早期诊断的紧迫性。当前研究现状表明,外周感觉损伤(如嗅觉、听觉和视觉)可能作为早期AD生物标志物,但敏感性和特异性尚存争议。触觉缺陷在AD临床前阶段已显现,如工作记忆受损和模式识别错误,且脊髓损伤与AD风险增加相关,AD病理标志(如Aβ和Tau)在脊髓中也有发现,提示脊髓可能易受AD早期影响。然而,触觉缺陷作为AD早期指标的直接证据及其机制(如Tau病理如何影响脊髓功能)仍不明确。验证触觉指标的诊断效能,明确触觉缺陷的分子机制,将有望开发非侵入性早期筛查工具,提升AD的预防和管理水平,改善患者预后。
研究内容
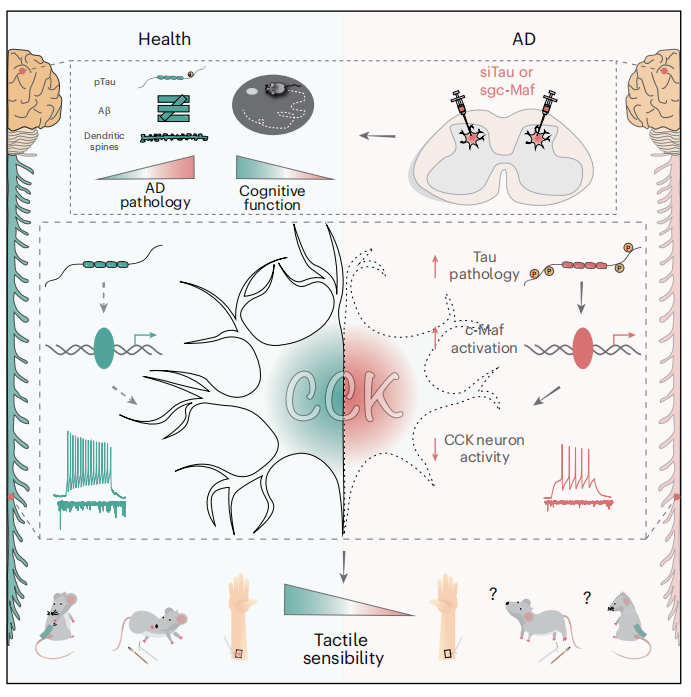
本研究旨在探究阿尔茨海默病(AD)中触觉缺陷的机制,重点关注脊髓Tau病理的作用。作者首先对AD患者和转基因小鼠模型(如3×Tg和PS19小鼠)进行行为测试,发现触觉功能损伤与MoCA评分负相关,且与脊髓Tau病理正相关。其次,利用分子技术证实Tau病理在脊髓背角II–IV层早期积累,而Aβ病理无明显贡献。通过单核RNA测序(snRNA-seq)分析,识别出脊髓中表达胆囊收缩素(CCK)的中间神经元对Tau高度易感。功能实验证明Tau病理通过激活转录因子c-Maf,导致CCK神经元活性抑制和突触传递受损,从而引发触觉缺陷。沉默Tau或c-Maf可逆转触觉功能障碍,并改善小鼠的认知表现,提示脊髓CCK神经元是AD早期病理的关键靶点,为开发非侵入性生物标志物和干预策略提供了新依据。
技术路线
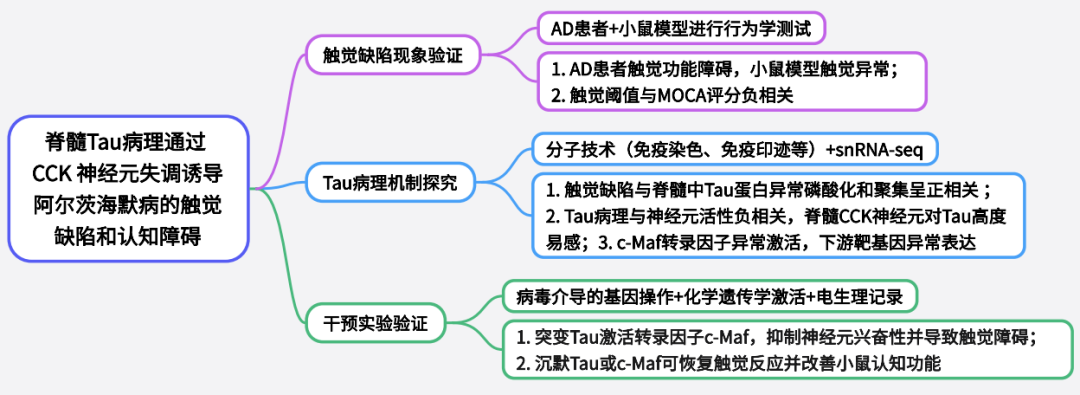
研究结果
Result1 早期AD患者和模型小鼠的触觉缺陷
作者首先评估了阿尔茨海默病(AD)患者的触觉功能,通过在前臂施加Von Frey丝状物测试其对无害和有害机械刺激的敏感性(图1a)。基于MoCA评分,216名老年参与者被分为健康对照组(HC,25-30分)、轻度认知障碍组(MCI,19-24分)和AD组(0-18分)。结果显示,在无害机械刺激(0.4克和0.6克)下,MCI和AD组的反应比率显著低于HC组(图1b),且其诱发反应所需的力阈值更高(图1c),且力阈值与MoCA评分呈负相关(图1d)。但各组在有害刺激(2.0克或4.0克)下的反应无显著差异(图1e)。此外,所有受试者的视觉模拟评分(VAS)与Von Frey施加的力呈正相关(图1f, g),表明,尽管MCI和AD患者存在触觉功能受损,但其痛觉感知仍保持正常。
随后,作者在3×Tg AD转基因小鼠中进行了轻触觉行为测试(图1h)。通过背部粘性胶带实验发现,2至7月龄3×Tg小鼠在5分钟内的总反应次数(如咬抓或抖动)显著少于野生型(WT)对照(图1i)。进一步使用Von Frey细丝和轻刷测试足底无毛皮肤,结果显示3×Tg小鼠对无害机械刺激的敏感性从2月龄起持续降低(图1j),且轻刷诱发的反应也明显减弱(图1k)。在3月龄时,68.4%的3×Tg小鼠在胶带、Von Frey和动态触觉测试中表现异常,而WT组仅3.5%(图1l)。这些数据一致表明,AD小鼠对轻触觉的感知能力受损。
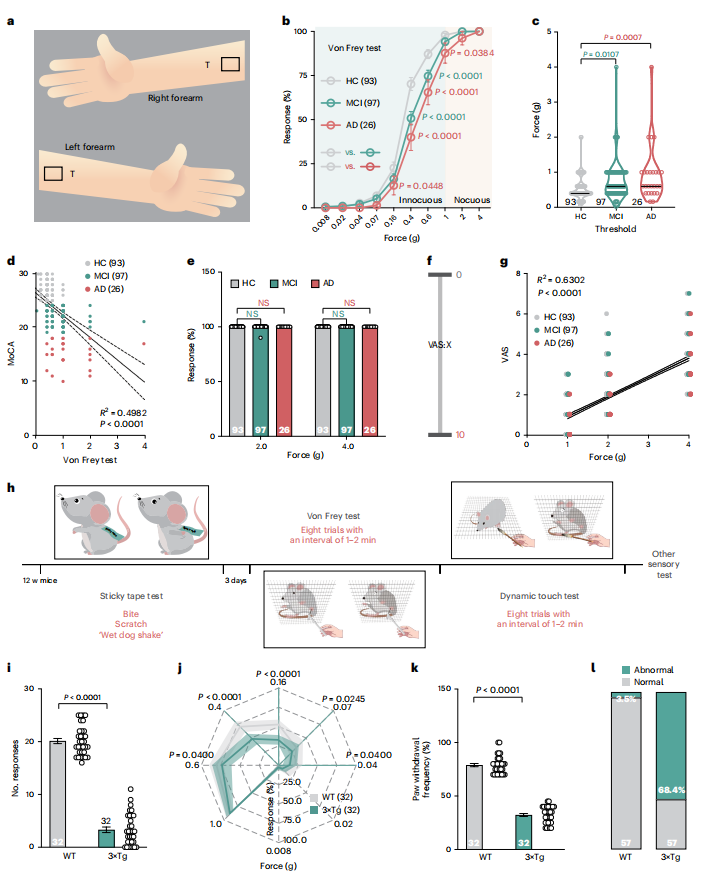
图1. 早期阿尔茨海默病(AD)患者及模型小鼠的触觉缺陷
Result2 脊髓神经元中的Tau病理导致AD中的触觉缺陷
为探究AD早期触觉缺陷是否由Tau病理、Aβ沉积或二者共同驱动,作者首先在AD患者脊髓中观察到Tau多个位点磷酸化水平升高(图2a,b)。利用特异性识别Tau寡聚体的TOC1抗体进行免疫染色,发现AD患者及Tau-P301S转基因小鼠(PS19)脊髓背角III–IV层均存在异常Tau聚集(图2c,d)。斑点印记分析进一步显示,AD病例的TOC1免疫反应性显著高于其他神经系统疾病(OND)对照组(图2e)。均相时间分辨荧光定量结果确认AD样本中Tau聚集水平更高,与上述发现一致(图2f)。
在PS19小鼠中,定量分析显示脊髓内T231、S262及S396位点的Tau磷酸化水平及总Tau(Tau5)表达均增加(图2g–j)。作者进一步构建加权公式以量化Tau病理程度(pTau),发现pTau值与野生型及PS19小鼠在胶带测试、Von Frey测试和动态触觉测试中的行为表现均呈负相关(图2k–n)。这些结果提示,脊髓中的Tau病理可能在AD早期触觉功能缺陷中起关键作用。
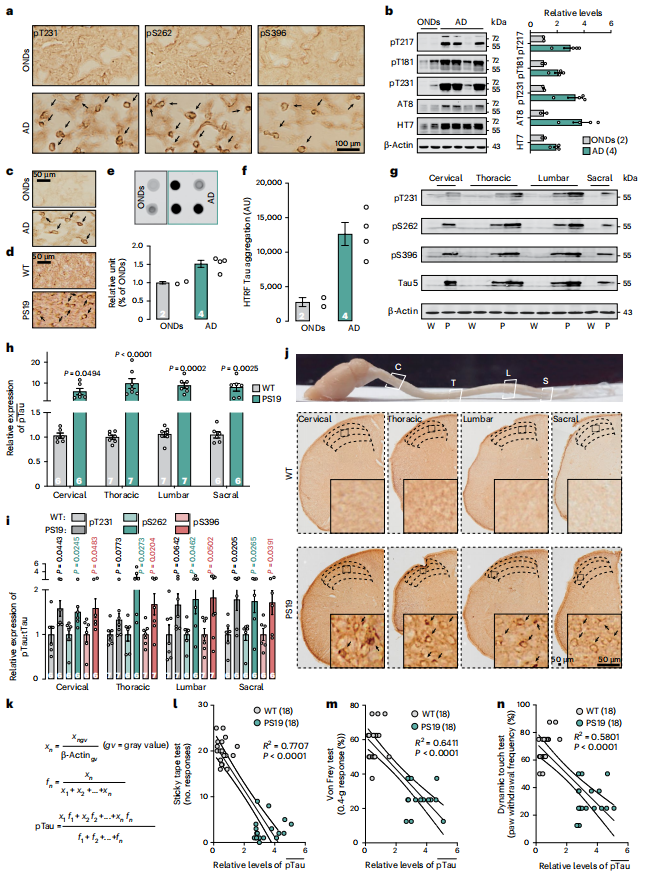
图2. PS19小鼠脊髓中的Tau病理学改变与触觉缺陷相关
Result3 Tau病理抑制脊髓CCK神经元活性
为阐明Tau病理损害触觉功能的机制,作者对PS19与WT小鼠腰段脊髓(L1–L4)背角进行单核RNA测序(snRNA-seq),系统绘制Tau应激下的细胞转录图谱。通过聚类及t-SNE降维分析,鉴定出8类谷氨酸能神经元、7类GABA能神经元及7类非神经元细胞(图3a)。利用AUCell算法评估神经元中神经原纤维缠结(NFT)相关基因集(NRG)的表达活性,发现NRG在神经元中显著富集,且在PS19小鼠的Cck、Prkgc(PKCγ)及Meis2表达的神经元中表达失调尤为突出(图3b,c)。进一步实验显示,在PS19小鼠及AD患者脊髓中,CCK神经元内T231、S262及AT8位点的Tau磷酸化水平显著高于其他神经元类型(图3d),且该病理变化在负责无害触觉传递的背角IIiv–IV层中特异性富集(图3e)。c-FOS标记显示,在胶带测试、Von Frey测试和动态触觉测试期间,PS19小鼠IIiv–IV层神经元活性降低(图3f–i)。与WT对照小鼠相比,神经元活性调节基因(ARGs)表达在六种神经元类型(包括CCK神经元)中最显著下调(图3j)。表明脊髓CCK神经元激活对触觉功能至关重要。
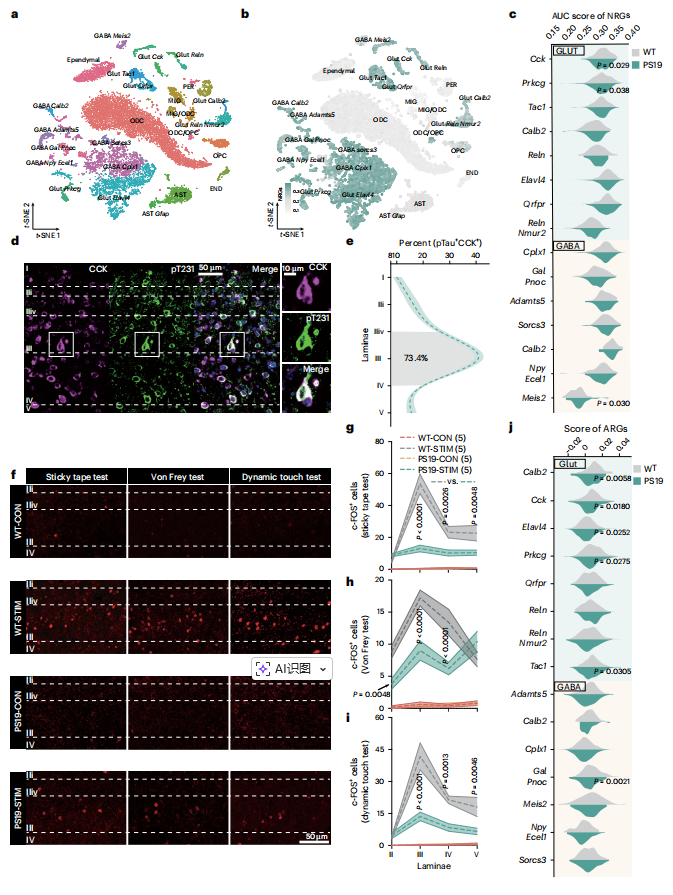
图3. Tau病理学使AD中的脊髓 CCK 神经元失活
为实时监测CCK神经元动态,作者将 CCK -Cre小鼠与PS19小鼠杂交构建PS19;CCK-Cre小鼠,并通过病毒介导在脊髓特异性表达Ca2+指示剂jGCaMP8s。钙成像显示,CCK 神经元对Von Frey刺激产生了激活反应(图4a,b)。随后,作者在PS19;CCK-Cre小鼠背角双侧注射靶向Tau的shRNA病毒(siTau)或对照病毒(图4c),发现沉默Tau可有效恢复小鼠在胶带测试、Von Frey测试及动态触觉测试中的行为表现(图4d–f)。电生理记录进一步证实,siTau组CCK神经元的自发性兴奋性突触后电流(sEPSCs)幅度和频率均得以恢复(图4g–k)。上述结果表明,特异性抑制脊髓CCK神经元中的Tau病理是改善AD相关触觉功能缺损的有效策略。
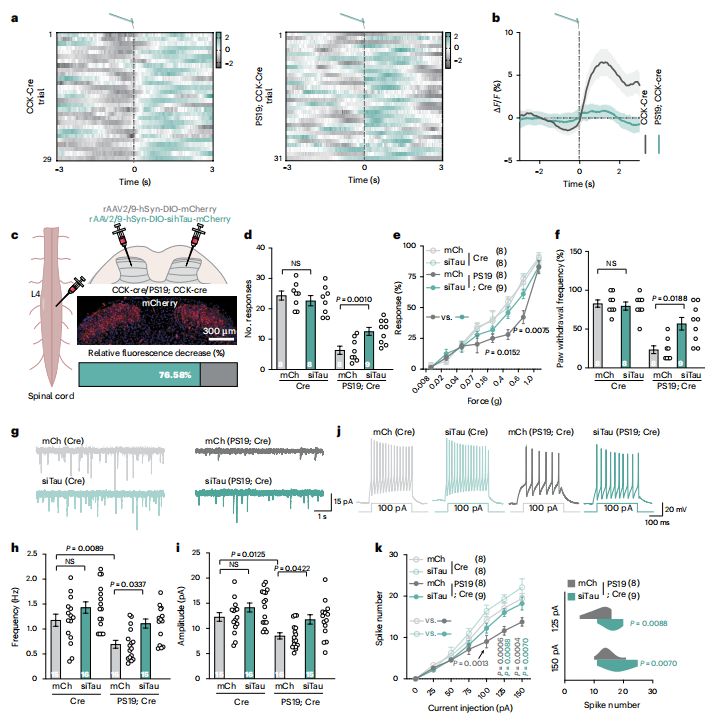
图4. 在 CCK 神经元中沉默Tau可恢复AD患者的触觉
Result4 c-Maf调节异常抑制CCK神经元活性
基于PS19小鼠脊髓CCK神经元活性降低的发现,作者进一步探究化学遗传激活该神经元能否逆转触觉缺陷。通过向PS19;CCK-Cre小鼠脊髓注射Cre依赖性Gq偶联设计受体(图5a),特异性表达于CCK神经元。给予氯氮平-N-氧化物(CNO)激活后,小鼠在胶带测试、Von Frey测试及动态触觉测试中的反应均得到部分改善(图5b–i),且未影响其他感觉与运动功能(图5j–s)。
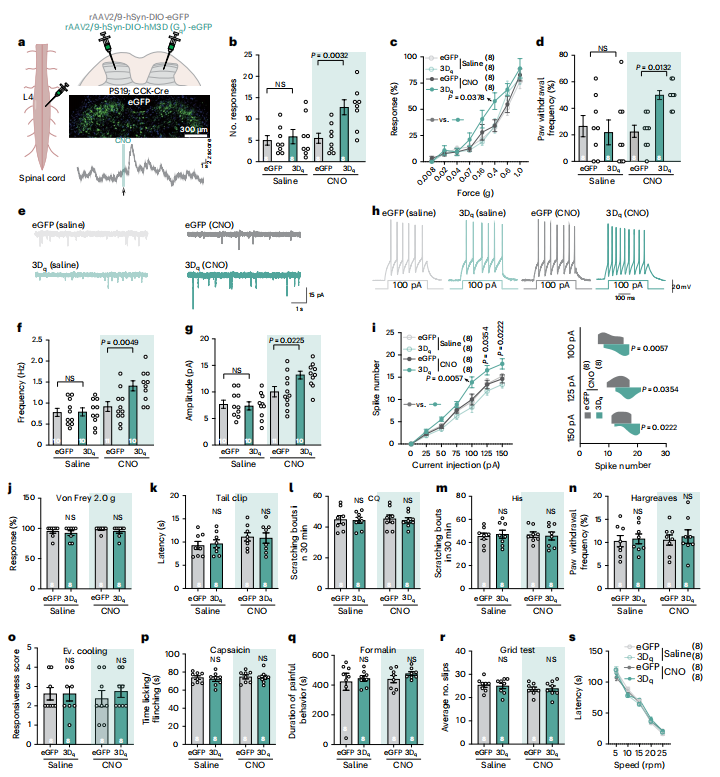
图5. CCK 神经元的化学遗传学激活逆转了触觉损伤
通过整合CCK神经元中失调基因、调控靶点及已报道的NFT相关基因,作者筛选出十个关键调控因子(图6a–c)。其中c-Maf因以下特征引起关注:①参与背角III/IV层感觉神经元发育;②在CCK神经元中高度富集;③在PS19小鼠及AD患者该区域CCK神经元中表达上调(图6d);④其表达与pTau水平呈正相关(图6e);⑤具有调节皮质兴奋性的功能。进一步分析显示,c-Maf可调控多个神经元活性相关基因(如Dlg2、Nrn1),这些基因在PS19小鼠CCK神经元中表达紊乱(图6f–h)。为验证c-Maf的功能,作者在PS19;CCK-Cre小鼠脊髓中注射靶向c-Maf的dCas9- KRAB /sgRNA的pLV病毒(图6i),特异性敲低其表达。结果显示,c-Maf敲低不仅挽救了触觉行为缺陷(图6j–l),还恢复了CCK神经元的sEPSC振幅与频率(图6m–q)。这些结果表明c-Maf在Tau病理介导的触觉功能缺损中发挥关键作用。
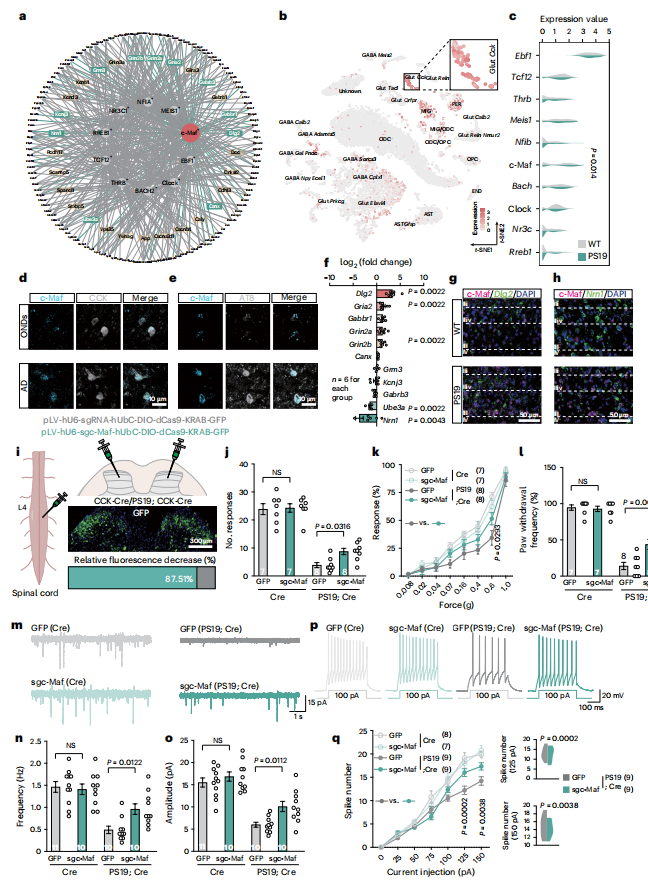
图6. CCK 神经元中的c-Maf调控子介导Tau病理学诱导的触觉缺陷
Result5 通过靶向脊髓CCK神经元中的Tau或c-Maf治疗AD
在明确脊髓CCK神经元中Tau病理及c-Maf介导的转录调控可诱发触觉缺陷的基础上,作者进一步探究此类早期触觉损伤是否与AD病程进展相关。首先,根据3月龄3×Tg小鼠的触觉表现将其分为触觉正常(NRM)与异常(ABN)两组(图1l)。至6月龄时,ABN小鼠在莫里斯水迷宫中表现出更长的潜伏期和更少的平台穿越次数(图7a,b),在巴恩斯迷宫中潜伏期更长且鼻触次数更少(图7c,d),其海马区树突棘密度降低,神经元内Tau病理加重,且Aβ斑块沉积多于NRM组(图7e–g)。这些结果与临床观察一致,提示触觉功能障碍与AD病理进展密切相关。
为探讨早期干预触觉缺陷能否延缓脑内病理发展,作者在3×Tg;CCK-Cre小鼠3月龄时向脊髓CCK神经元注射siTau病毒。结果显示,siTau处理可完全恢复小鼠的触觉行为反应(图7h–j)。更重要的是,至6月龄时,siTau组小鼠在莫里斯水迷宫和巴恩斯迷宫任务表现更好,而开放场和高架十字迷宫任务无显著差异(图7k–n)。在12月龄时,其树突棘密度更高,神经元pTau水平及Aβ斑块负荷均显著降低(图7o–q)。通过靶向c-Maf的干预实验也观察到类似效应(图7r–aa)。综上,特异性沉默脊髓CCK神经元中的Tau或c-Maf表达,不仅能挽救触觉功能,还可有效延缓AD相关病理进程。
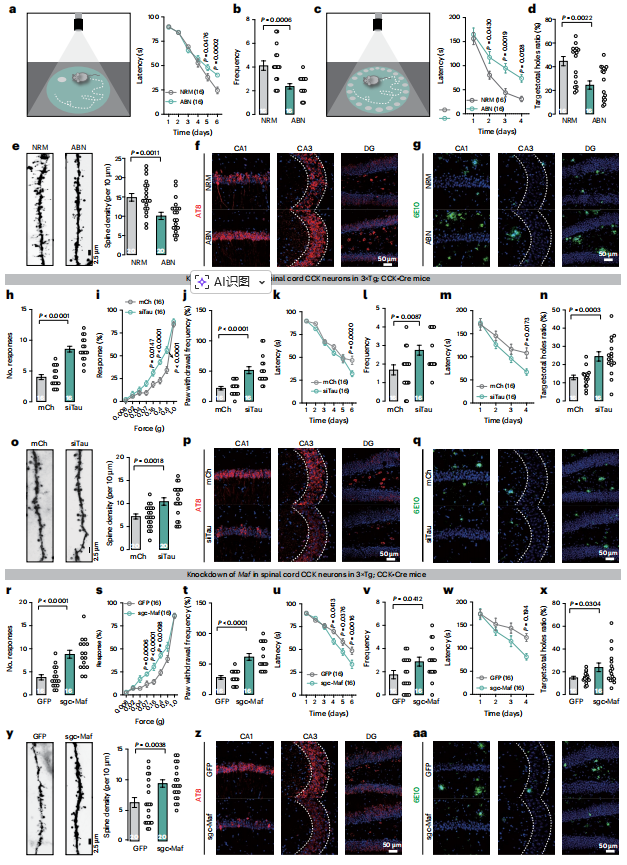
图7. 在CCK神经元中沉默Tau或c-Maf可延缓AD的进展
研究结论
本研究揭示了阿尔茨海默病(AD)中脊髓Tau病理通过破坏胆囊收缩素(CCK)神经元功能导致早期触觉缺损的新机制。研究发现,脊髓背角CCK神经元对Tau病理具有特异性易感性,其异常会通过转录因子c-Maf介导的基因表达失调抑制神经元活性,进而引发触觉功能障碍。重要的是,这种触觉缺损与认知衰退显著相关,且在AD早期阶段即可出现。靶向脊髓CCK神经元中的Tau或c-Maf通路不仅能恢复触觉功能,还能延缓认知障碍进展,为AD的早期干预提供了新的治疗策略和靶点。
参考文献:
Zhou, Y., Li, WL., Liu, ZQ. et al. Spinal cord Tau pathology induces tactile deficits and cognitive impairment in Alzheimer’s disease via dysregulation of CCK neurons. Nat Neurosci (2025). https://doi.org/10.1038/s41593-025-02137-4






