前言
2025年12月15日,浙江大学医学院尚敏、傅国胜、钱俊斌、马博轩团队在国际权威期刊Nature Communications在线发表题为“Exercise-induced histone lactylation in monocyte-derived macrophages restores cardiac immune homeostasis and function in sepsis-induced cardiomyopathy”的研究论文。该研究首次揭示运动通过重编程单核细胞代谢、促进组蛋白乳酸化,调控巨噬细胞功能转换,进而修复脓毒症所致心肌损伤的全新机制,为脓毒症心肌损伤及相关心血管疾病的治疗提供了创新性策略。主要通过表观遗传组学(聚焦组蛋白乳酸化修饰)分析,结合单细胞转录组测序和相关细胞功能验证与动物模型实验,发现运动可诱导单核细胞源巨噬细胞发生组蛋白乳酸化修饰,该修饰能调控巨噬细胞表型重塑(抑制M1促炎型巨噬细胞、增加抗炎修复型巨噬细胞),进而重构脓毒症心肌病模型中的心脏免疫微环境稳态,减轻心肌病理损伤,最终改善心脏收缩与舒张功能,阐明了运动通过巨噬细胞表观遗传调控干预脓毒症心肌病的核心机制。

发表期刊:Nature Communications
影响因子:15.7
涉及的欧易生物服务产品:单细胞转录组测序
研究背景
脓毒症心肌病的临床困境
脓毒症ICU主要致死原因,60%脓毒症患者并发SICM,以心肌收缩/舒张功能障碍、心肌炎症浸润及心肌细胞凋亡为核心病理特征,具体表现为左室射血分数下降、心室扩张,其死亡率是无心脏功能障碍脓毒症患者的3倍。其发病机制与心脏局部免疫稳态失衡密切相关——单核细胞源巨噬细胞作为心脏免疫微环境的关键调控细胞,在脓毒症状态下心脏免疫稳态失衡会加重心肌损伤并加剧心功能恶化,是SICM 病理进程中的核心驱动因素之一。
运动与心血管保护的机制缺口
另一方面,运动作为生理性干预方式,已被证实可广泛调控免疫细胞功能与机体炎症反应,对心血管疾病具有保护作用,但运动如何通过代谢重编程调控免疫细胞的表观遗传修饰(尤其是新型组蛋白修饰)干预SICM中巨噬细胞功能重塑、进而恢复心脏免疫稳态与心功能的具体机制尚未明确。
技术路线
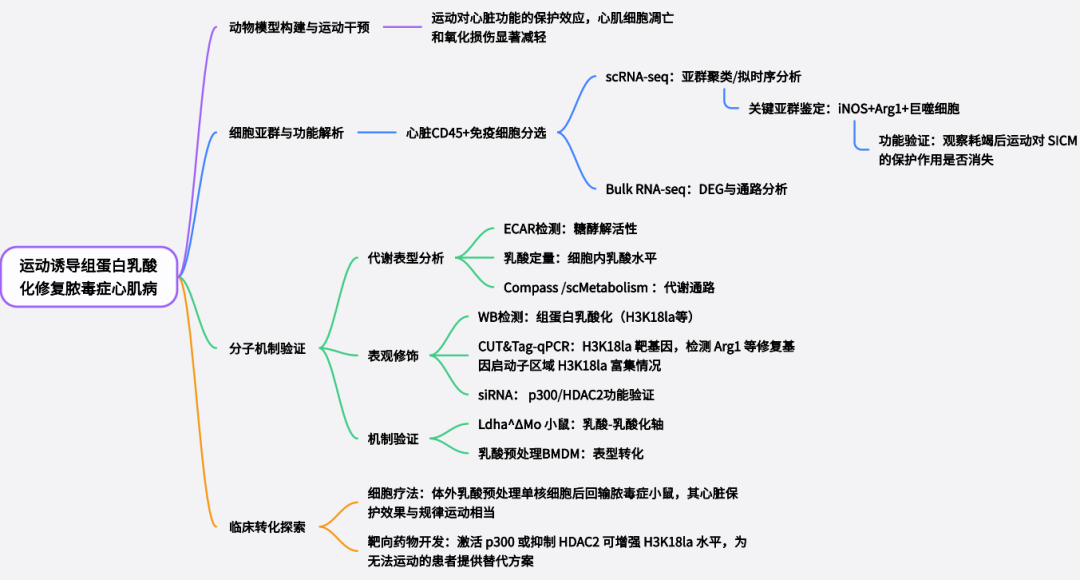
研究内容
该研究围绕脓毒症心肌病(SICM)的免疫失衡核心问题,系统探究了运动介导的表观遗传调控机制,首先通过构建SICM动物模型与运动干预体系,结合单细胞转录组分离培养技术,明确运动对单核细胞源巨噬细胞功能的调控作用;其次,采用表观遗传组学技术聚焦组蛋白修饰,鉴定出运动可显著诱导单核细胞源巨噬细胞发生组蛋白乳酸化修饰,进一步通过分子生物学实验(如 ChIP-qPCR、Western blot等)验证该修饰的特异性与表达特征;随后,深入探究组蛋白乳酸化的功能机制,通过基因沉默、过表达等手段,证实该修饰可直接调控巨噬细胞极化相关基因的转录表达,进而抑制M1 型促炎表型活化、促进M2型抗炎修复表型极化,减少促炎细胞因子(TNF-α、IL-6)分泌并增加抗炎因子(IL-10)释放;最后,通过巨噬细胞移植实验与体内干预验证,明确运动诱导的巨噬细胞组蛋白乳酸化修饰可通过重塑心脏免疫微环境,减轻SICM模型中心肌炎症浸润、心肌细胞凋亡及纤维化,最终恢复心脏收缩与舒张功能,完整解析了 “运动-巨噬细胞组蛋白乳酸化-心脏免疫稳态-心功能改善” 的调控链条。
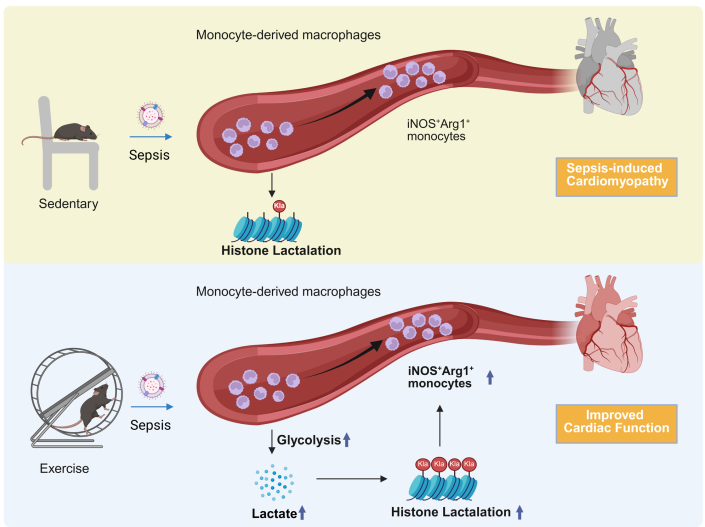
研究结果
1. 规律运动通过调节心脏免疫微环境保护SICM心脏功能
a. 运动对SICM小鼠的表型保护作用
小鼠经3个月自愿转轮运动后,腹腔注射脂多糖(LPS)构建SICM模型,结果显示:运动组小鼠体温下降幅度减少30%、体重丢失减少25%,左室射血分数(EF)和缩短分数(FS)分别提升21%和34%;且心肌凋亡(TUNEL染色)和氧化损伤(DHE 染色)水平降低50%以上,血清促炎因子IL-1β、TNF-α浓度显著下调。
b. 转录组层面的机制提示
bulk RNA-seq分析显示,运动在SICM状态下调控447个差异基因(DEG),主要抑制SICM诱导的趋化因子应答、细胞趋化等促炎通路,同时激活心肌动作电位、心肌收缩等心脏功能相关通路;同时免疫浸润分析结果发现,运动不改变心肌CD68+巨噬细胞总数,但使促修复型Arg1+巨噬细胞占比提升104%。
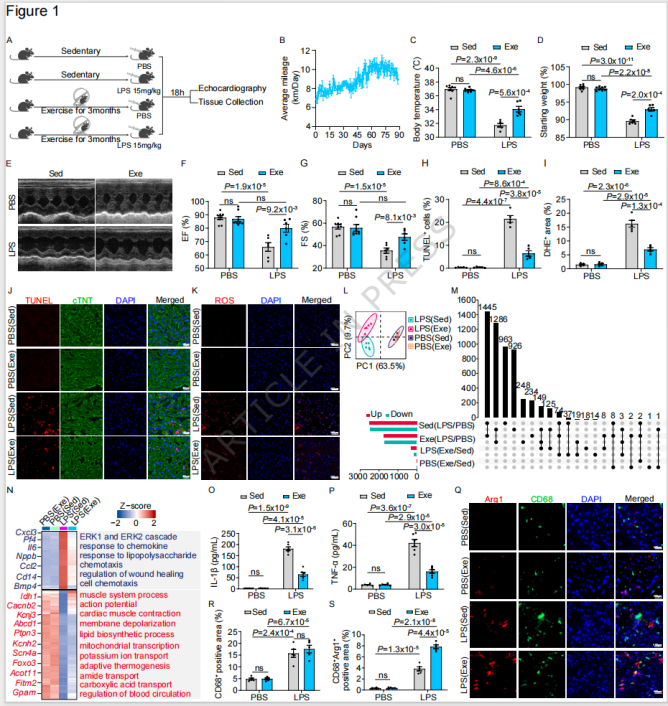
图1 规律体育锻炼通过调控心脏免疫微环境保护SICM心脏功能
2. 运动重塑SICM心脏免疫图谱,鉴定关键单核细胞-巨噬细胞亚群
对SICM小鼠心脏CD45+免疫细胞测序,鉴定出13类细胞群(巨噬细胞、单核细胞、中性粒细胞、T细胞等),其中单核细胞和巨噬细胞占比近50%;脓毒症显著增加心肌单核细胞和中性粒细胞浸润,而运动进一步促进单核细胞向心脏募集(提升40%)。
b. 关键功能亚群:iNOS+Arg1+单核细胞衍生巨噬细胞
通过二次聚类鉴定出6个单核-巨噬细胞亚群,其中运动诱导的iNOS+Arg1+单核细胞亚群具有独特功能:同时表达促炎基因(iNOS、IL-6)和促修复基因(Arg1、Fabp5);细胞轨迹分析(Monocle2)显示,该亚群由Ly6c2high促炎单核细胞分化而来,在SICM早期发挥抗菌作用,后期加速向 Arg1+修复型巨噬细胞转换;特异性抑制该亚群的iNOS或Arg1(通过Ly6C靶向纳米抑制剂),可完全阻断运动对SICM的心脏保护作用,证明其是运动保护的“效应亚群”。
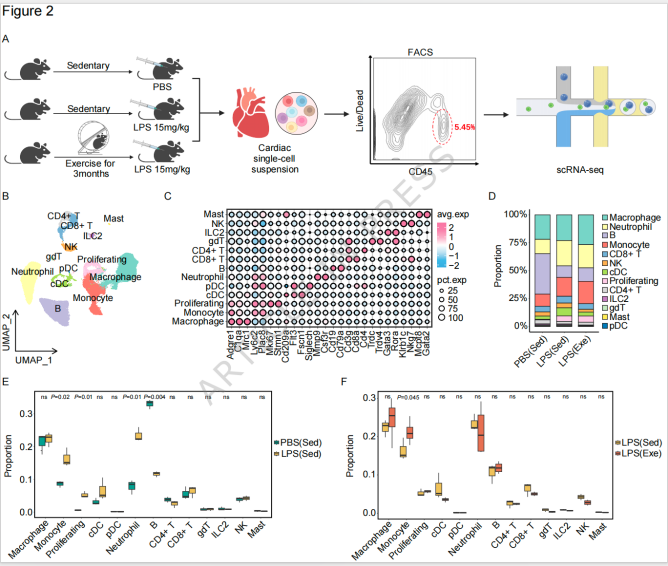
图2 运动调控脓毒症心脏免疫微环境
3. 运动通过单核细胞糖酵解-组蛋白乳酸化调控巨噬细胞功能
a. 运动诱导单核细胞代谢重编程
单细胞代谢分析(scMetabolism)和Seahorse实验显示,运动使单核细胞糖酵解活性提升55%,细胞内乳酸浓度增加50%,而三羧酸循环(TCA)活性降低;人SICM患者外周血单核细胞糖酵解酶LDHA表达显著升高,提示该代谢特征在人类中保守。
b. 组蛋白乳酸化是代谢与表观遗传的关键桥梁
运动显著诱导单核细胞和心脏巨噬细胞的全局组蛋白乳酸化(Pan-Kla),且在SICM状态下进一步增强;
特异性敲除髓系细胞LDHA(LdhaΔMo小鼠):
完全阻断运动诱导的组蛋白乳酸化;
消除运动对SICM小鼠的体温、体重及心脏功能保护作用;
心肌Arg1+巨噬细胞占比下降70%,证明乳酸是运动调控心脏免疫的核心代谢物。
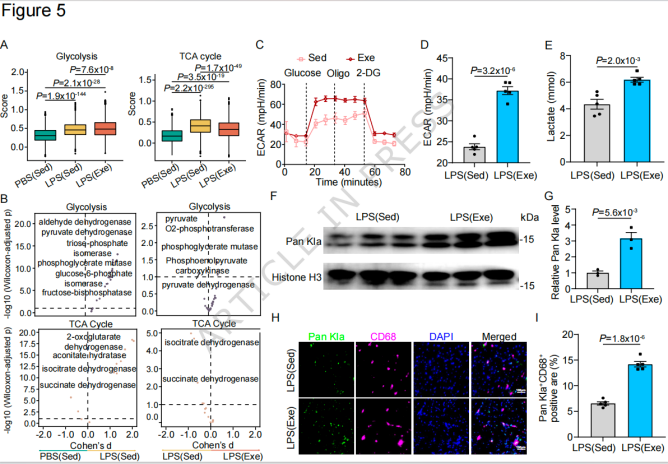
图3 运动增强SICM中单核细胞衍生巨噬细胞的糖酵解及后续组蛋白乳酸化
4. H3K18la是运动诱导的关键乳酸化位点,由p300/HDAC2调控
a. 运动特异性诱导H3K18乳酸化
检测8个组蛋白乳酸化位点(H3K9la、H3K14la、H3K18la 等),发现仅H3K18la在运动后显著升高,且在LPS刺激下进一步增强,其变化趋势与Pan-Kla完全一致;
人体实验验证:规律运动人群(每周3次 × 30分钟运动)外周血单核细胞H3K18la和Pan-Kla水平,较久坐人群分别提升60%和45%,外源性乳酸(20mM)处理可模拟该效应。
b. H3K18la的修饰酶鉴定
siRNA干扰实验显示:
组蛋白乙酰转移酶p300是H3K18la的“写入酶”,敲低p300可阻断乳酸诱导的H3K18la;
组蛋白去乙酰化酶HDAC2是H3K18la的“擦除酶”,敲低 HDAC2使H3K18la水平提升2倍,而HDAC1/3无此效应。
c. H3K18la调控Arg1表达的分子机制
CUT&Tag-seq分析显示,H3K18la在Arg1基因启动子区富集,运动可进一步增强该富集水平;乳酸预处理的骨髓来源巨噬细胞(BMDM)在LPS刺激后,Arg1表达上调4倍,iNOS表达无显著变化,加速向修复表型转换。
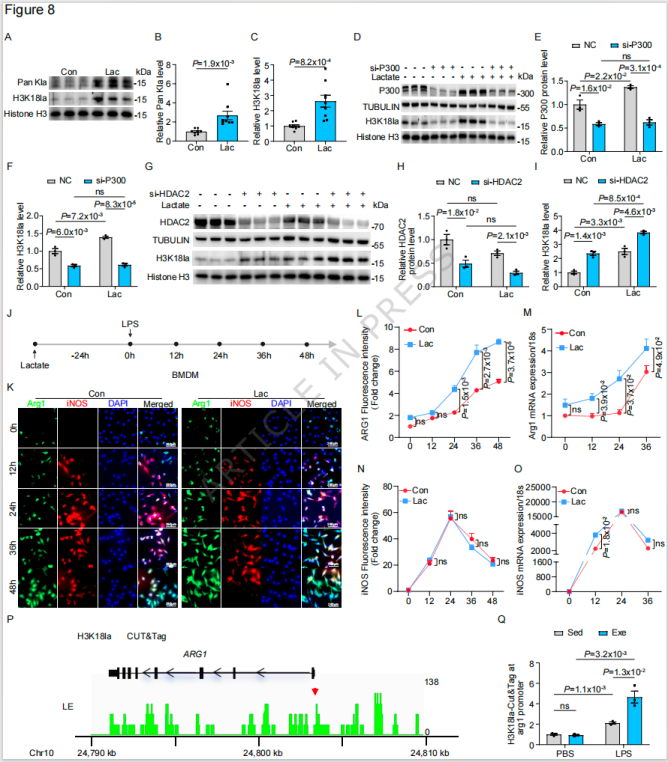
图4 运动通过p300和HDAC2增强单核细胞中H3K18组蛋白乳酸化
研究结论
1. 规律运动通过诱导单核细胞糖酵解增强,促进乳酸生成,进而激活H3K18la表观遗传修饰。
2. H3K18la通过调控Arg1等修复基因表达,驱动iNOS+Arg1+巨噬细胞亚群形成,加速心脏巨噬细胞从促炎向修复表型转化,恢复心脏免疫稳态。
3. 乳酸化单核细胞过继转移可模拟运动的保护作用,为SICM提供新型细胞治疗策略。






