前言
2025年11月19日,四川大学华西口腔医院黄汉尧团队在Advanced Materials(IF=26.8)上发表题为“LPS-Binding Hydrogel for TLR4-Mediated Microbiota-Immune Modulation”的研究论文。这项研究开发了一种能同步清除细菌和其中毒素LPS的新型水凝胶,通过重塑伤口处的免疫微环境,成功促进了复杂的口腔-鼻腔穿孔伤口的愈合。本项目由欧易生物提供16S rRNA测序、宏基因组测序和单细胞转录组测序等服务内容。

发表期刊:Advanced Materials
影响因子:26.8
涉及的欧易生物服务产品:16S rRNA测序、宏基因组测序、单细胞转录组测序(MobiNova-100)
单细胞测序样本:
组织类型:小鼠,全层颚黏膜组织
时间点:基线(健康对照)、损伤后第3天(炎症期)、第7天(增殖期)、第10天(重塑期)
处理组:PBS对照组、OCMC-PMBP水凝胶治疗组
技术路线
研究背景
口腔-鼻腔穿孔性伤口(如腭裂术后)因解剖结构复杂、微生物环境丰富,常伴随菌群失调和愈合障碍。脂多糖(LPS)作为革兰氏阴性菌的关键成分,通过激活TLR4信号通路引发过度炎症,是阻碍愈合的重要因素。然而,传统治疗方法难以有效清除膜内嵌的LPS活性核心脂质A。
本研究设计了一种协同LPS结合水凝胶(OCMC-PMBP),整合了多粘菌素B(PMB) 的膜裂解能力与聚乙烯亚胺(PEI)的静电捕获能力,旨在实现细菌清除、 LPS中和、免疫微环境重塑的三重目标。
研究内容
本研究通过临床样本分析和小鼠模型实验,首次证实LPS-TLR4信号通路是导致口腔-鼻腔穿孔性伤口愈合障碍的关键机制。为突破传统治疗局限,研究团队创新性地开发了OCMC-PMBP水凝胶,该材料通过PMB靶向裂解革兰氏阴性菌释放LPS,并利用PEI高效捕获游离LPS,实现“菌毒兼治”。通过整合16S rRNA测序、宏基因组学和单细胞转录组学等多组学技术,研究从单细胞分辨率层面揭示了该水凝胶的治疗机制:它不仅能够维持菌群稳态、抑制LPS生物合成,更重要的是通过重编程免疫微环境——促使中性粒细胞和巨噬细胞从促炎表型向抗炎/再生表型转化,并协调巨噬细胞与成纤维细胞通过Spp1-Cd44、Tgfb1-Tgfbr1等信号通路建立促再生相互作用,最终将伤口微环境从慢性炎症状态转向组织再生状态,显著加速上皮再生和胶原重塑。这项研究为感染性黏膜伤口的治疗提供了兼具抗菌、解毒和免疫调节功能的创新性解决方案。
研究结果
1.LPS-TLR4信号通路导致鼻咽穿孔创面愈合障碍
作者首先通过临床分析揭示了脂多糖(LPS)与口腔-鼻腔穿孔性伤口愈合障碍的强关联。对腭裂患者术前、术后及口鼻瘘(ONF)患者的微生物样本进行16S rRNA测序,发现术后微生物多样性显著下降,且在形成ONF时,菌群结构发生显著改变,其中革兰氏阴性菌的丰度在术后初期下降后再度反弹,伴随着伤口渗出液中LPS水平的显著升高(图1a-e)。为明确其因果关系,研究团队利用Tlr4基因敲除(Tlr4⁻/⁻)小鼠模型进行验证。结果表明,尽管伤口局部LPS水平相当,但Tlr4⁻/⁻小鼠的伤口愈合速度远快于野生型小鼠,并且其免疫细胞浸润、促炎因子(TNF-α, IL-6)表达以及TLR4下游信号通路的激活水平均显著降低(图1f-j)。综上,临床现象与动物实验共同证实,LPS通过激活TLR4信号通路,驱动了有害的过度炎症反应,是阻碍此类复杂伤口愈合的关键机制。
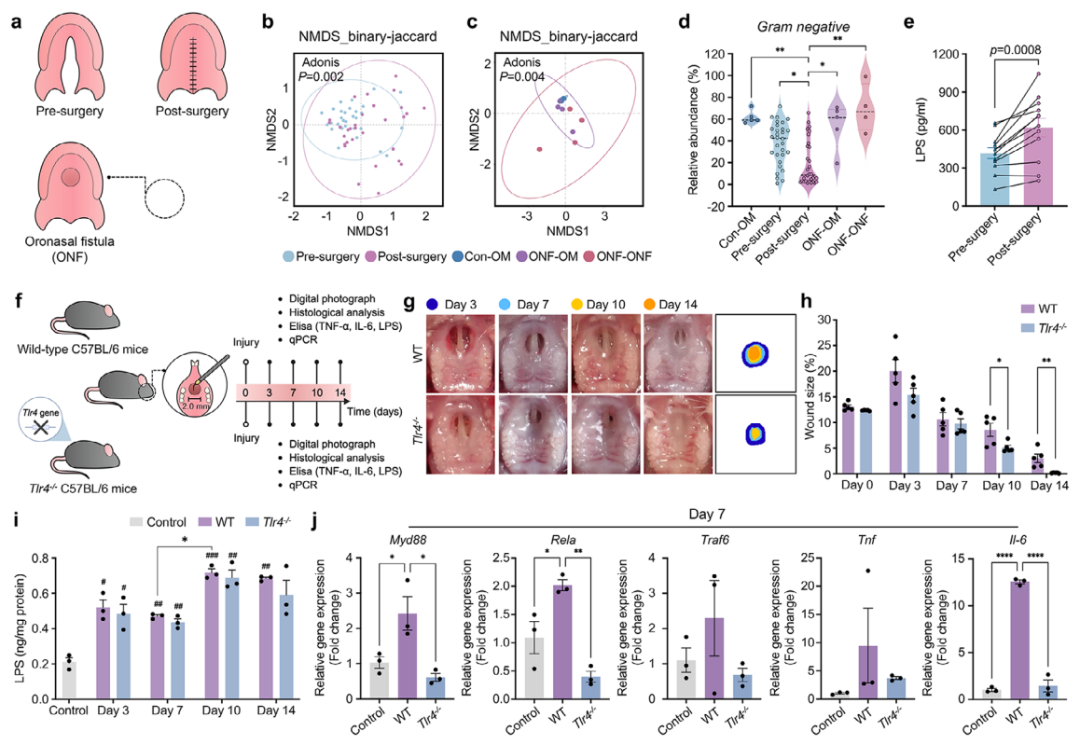
图1. LPS-TLR4信号通路导致口鼻穿孔创面愈合障碍
2. LPS结合水凝胶的设计与表征
本研究成功构建了一种协同性LPS结合水凝胶(OCMC-PMBP)。该水凝胶以氧化羧甲基纤维素为骨架,通过希夫碱反应共价接枝多粘菌素B与聚乙烯亚胺(图2a)。FT-IR光谱证实了醛基消耗和希夫碱键形成(图2b),流变学测试显示其具有稳定网络结构和良好剪切稀化性(图2c)。功能研究表明,OCMC-PMBP与革兰氏阴性菌外膜结合最稳定(图2d,e),能引起膜结构破裂(图2f),并对革兰氏阴性菌表现出选择性杀灭能力(图2g)。机制上,OCMC-PMBP与LPS的结合能仅次于内源性LPS结合蛋白(LBP)(图2i,j),能有效抑制TLR4激活(图2h),实现在免疫识别前原位清除LPS,从源头阻止免疫过度激活。
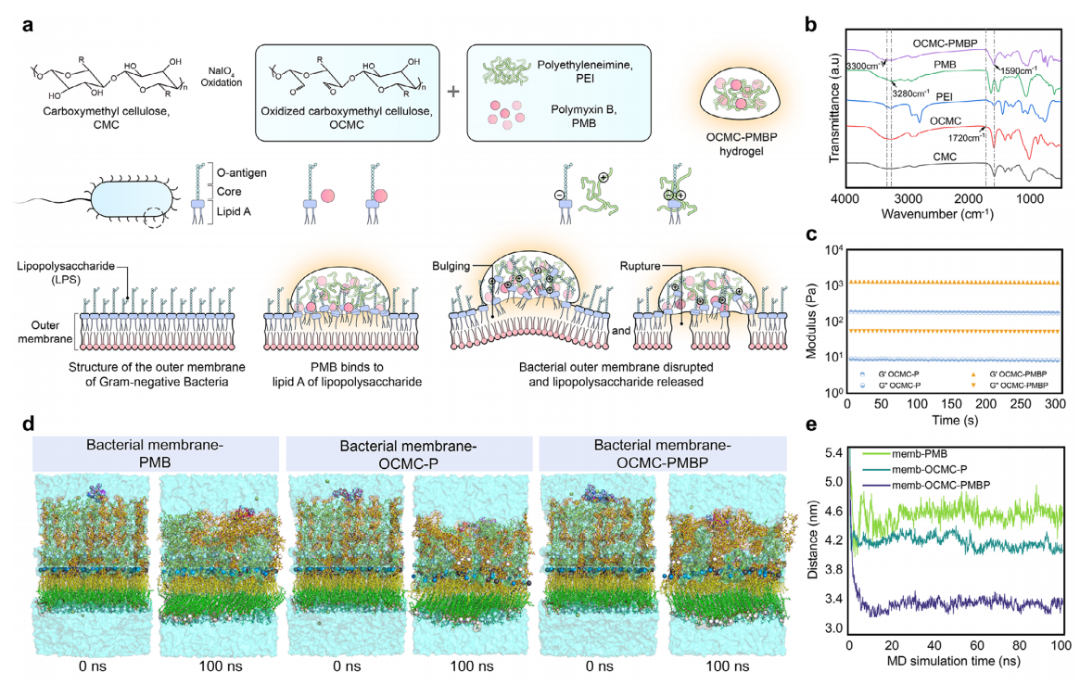
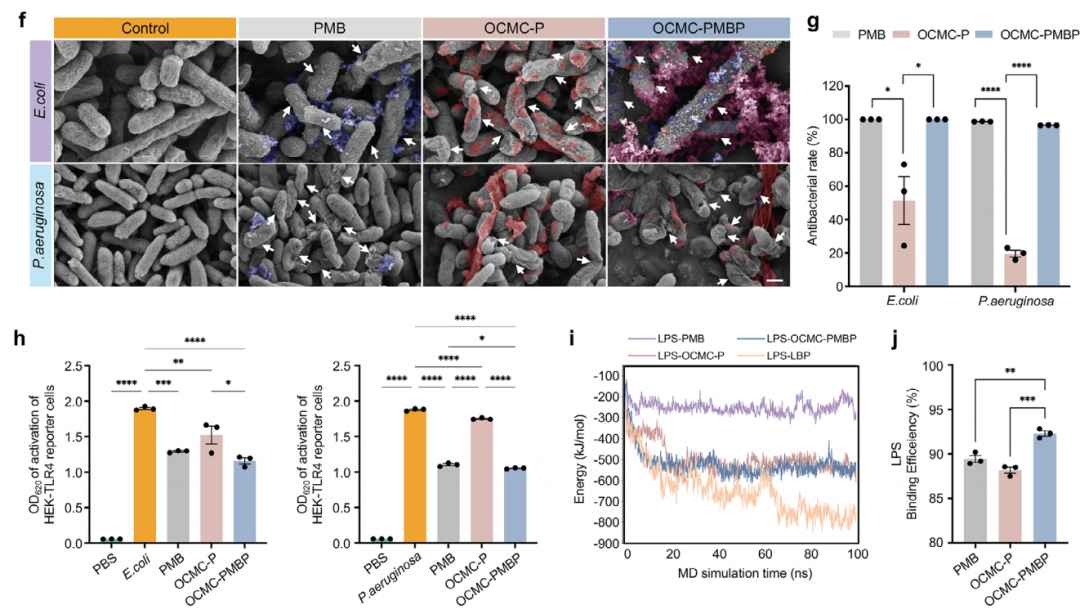
图2. LPS结合水凝胶的设计与表征
3. LPS结合水凝胶加速口腔-鼻腔穿孔性伤口愈合
在动物模型中,OCMC-PMBP水凝胶展现出卓越的治疗效果与良好的生物安全性。如图3a-e所示,在小鼠口腔-鼻腔穿孔伤口模型中,每日局部应用OCMC-PMBP能够有效维持小鼠体重与存活率,且未观察到明显毒性反应。宏观愈合过程显示,OCMC-PMBP治疗组的伤口闭合速度显著快于各对照组,至第14天时已接近完全愈合。
在分子机制层面,该水凝胶展现出强大的炎症调控能力。动态监测发现,OCMC-PMBP治疗能显著降低伤口组织中关键促炎因子TNF-α和IL-6的水平(图3f,g)。值得注意的是,它还能纠正愈合早期TGF-β的异常升高(图3h),这表明水凝胶能够将失调的炎症反应重新导向正常的促再生轨道,为组织修复创造有利的微环境。
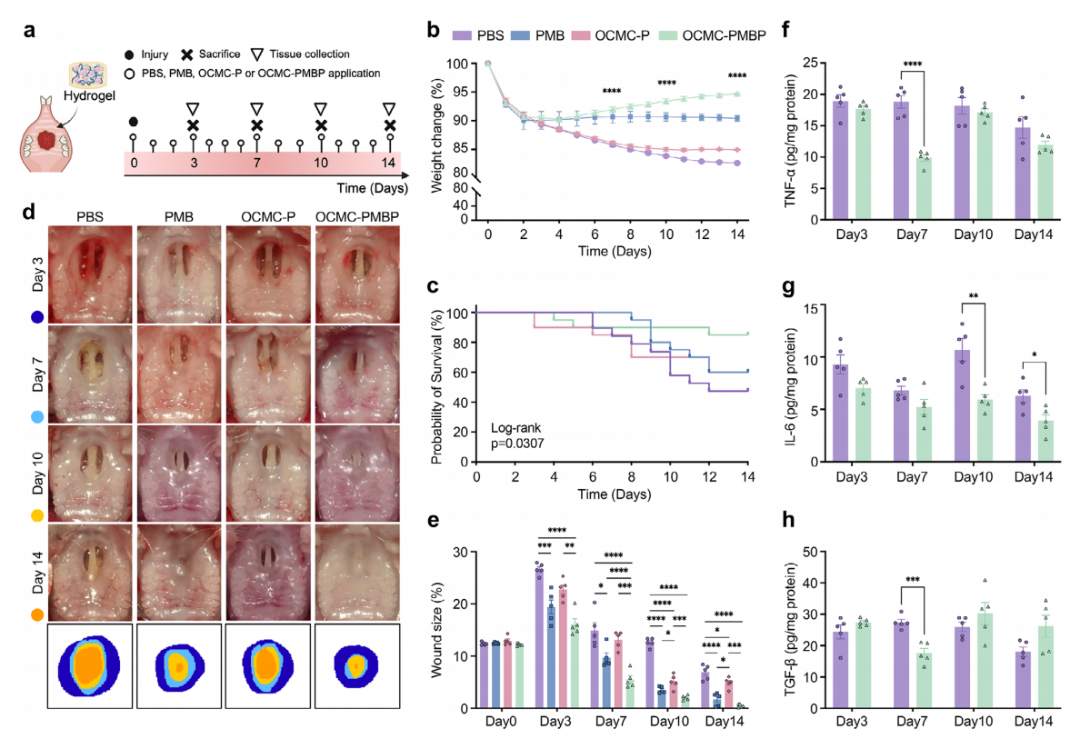
图3. LPS结合水凝胶加速口鼻穿孔性伤口愈合
4.LPS结合水凝胶维持菌群稳态并减少LPS积累
本研究通过多组学分析证实,OCMC-PMBP水凝胶能够有效维持伤口菌群稳态并减少LPS积累。通过对小鼠伤口菌群的16S rRNA测序分析发现,与PBS组相比,OCMC-PMBP治疗组的微生物群落随时间变化更小,与健康对照组的距离更近,表现出更高的菌群稳定性(图4a,b)。同时,治疗组保持了更高的菌群丰富度和均匀度,优势菌属的变化也更为保守(图4c,d)。
进一步的宏基因组学分析揭示了其作用机制:OCMC-PMBP治疗显著抑制了与LPS生物合成、DNA复制、分泌系统和生物膜形成相关的微生物功能通路(图4e,f)。表型预测结果与此一致,显示治疗组伤口中革兰氏阴性菌的比例始终维持在较低水平(图4g)。最终,体内LPS水平监测直接证实,OCMC-PMBP治疗能有效减少伤口组织中LPS的积累(图4h),从功能到表型完整地阐释了该水凝胶维持微环境稳态的作用路径。
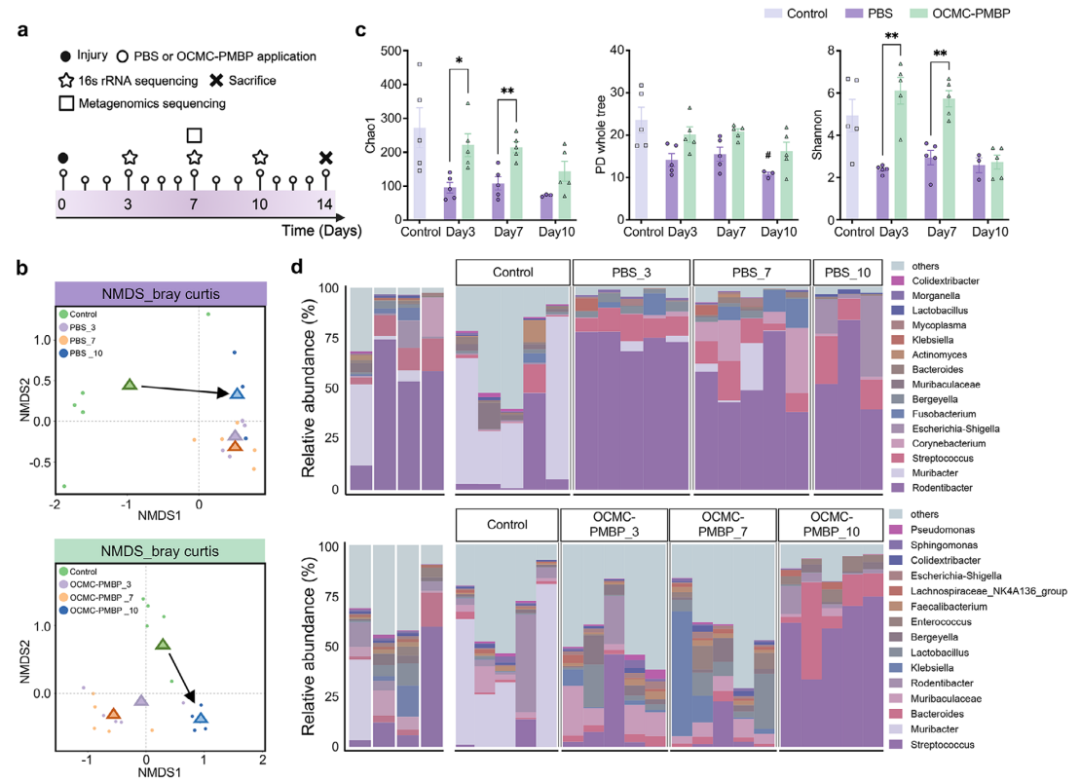
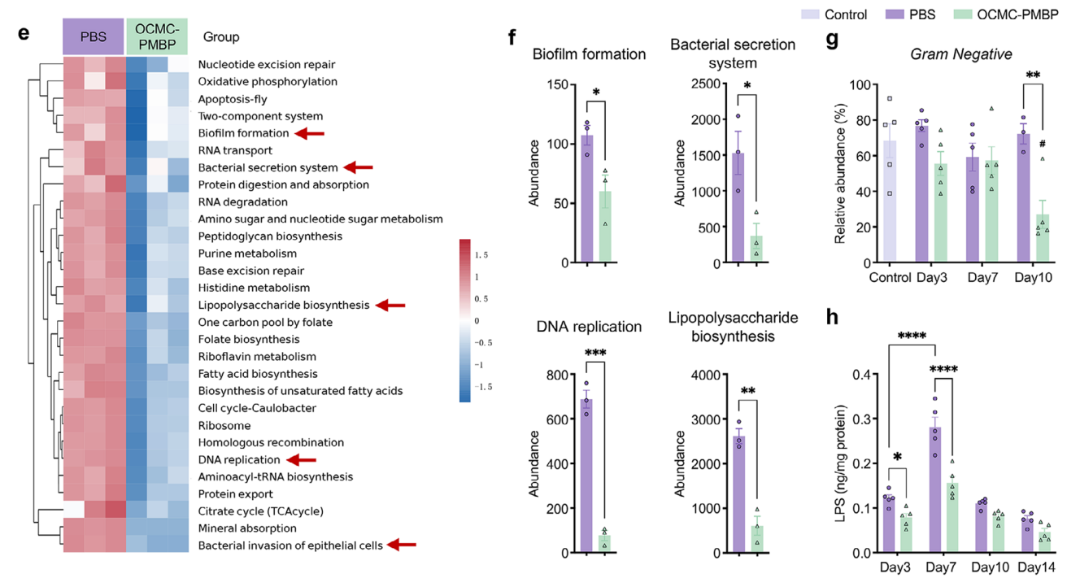
图4. LPS结合水凝胶维持微生物群稳态、抑制LPS合成并减少LPS积累
5.LPS结合水凝胶在炎症期重编程LPS-TLR4介导的免疫微环境
基于单细胞转录组测序(scRNA-seq)的深入分析,本研究从细胞层面揭示了OCMC-PMBP水凝胶重塑免疫微环境的关键机制。研究首先明确了伤口愈合过程中10种主要细胞类型的动态变化(图5a,b),并发现TLR4信号的中枢位于炎症期的中性粒细胞和单核-巨噬细胞;OCMC-PMBP处理能显著降低这些关键细胞中TLR4的表达水平(图5c,d)。
进一步的免疫细胞亚群分析显示,水凝胶治疗能够直接调控先天免疫细胞的表型极化。在中性粒细胞中,OCMC-PMBP促使细胞从促炎表型(Ncf1+Stat2+) 向抗炎表型(Ncf1+Arg1+) 转化(图5e-g);在巨噬细胞中,则显著增加了抗炎巨噬细胞(Cd86+Cd163+) 的比例,同时减少了促炎巨噬细胞(Cd86+Nos2+)(图5h-j)。
更为重要的是,细胞通讯分析揭示了水凝胶协调不同免疫细胞协同作用的机制:在OCMC-PMBP治疗组中,中性粒细胞通过CSF信号通路促进单核细胞向抗炎巨噬细胞分化(图5k,l),同时抑制了驱动促炎极化的Notch信号通路(图5m,n)。这一发现阐明了该水凝胶通过精准调控免疫细胞间的“对话”,从而促进炎症消退和组织修复的新机制。
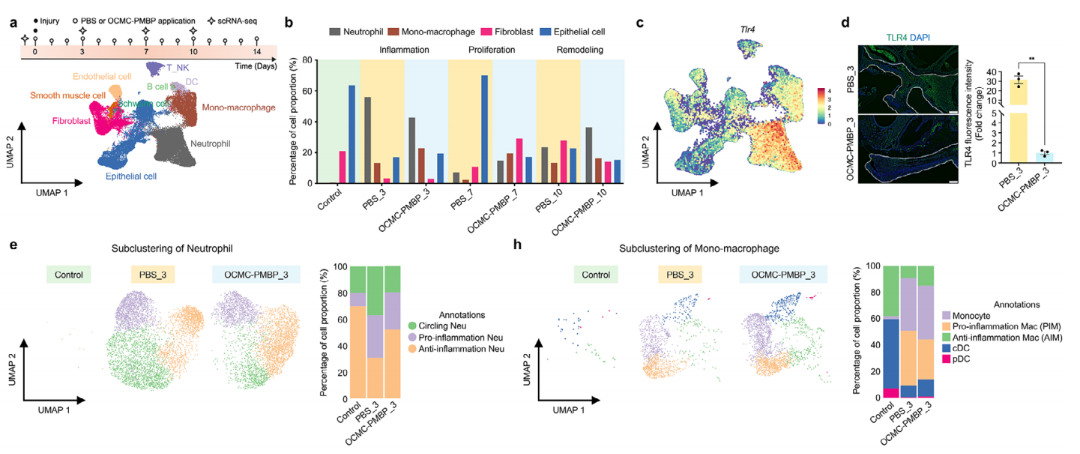
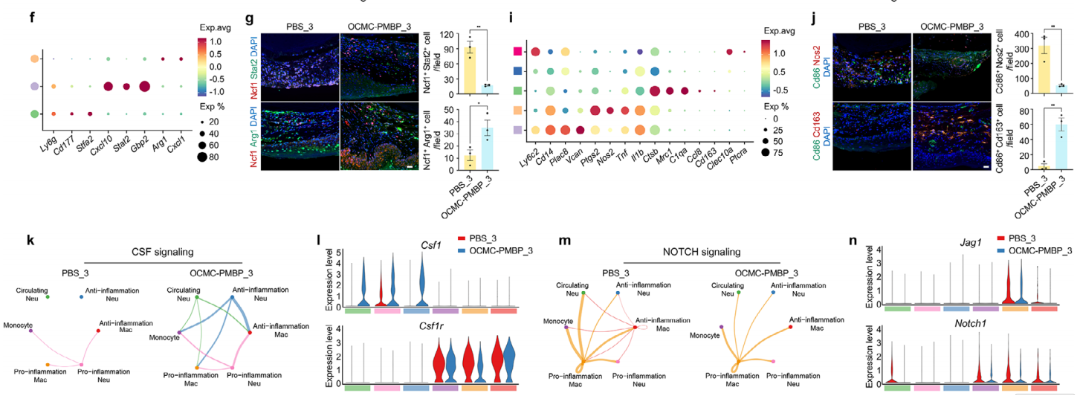
图5. LPS结合水凝胶在炎症阶段重新编程LPS-TLR4介导的免疫微环境
6. LPS结合水凝胶在增殖与重塑期调控巨噬细胞-效应细胞交互
本研究通过单细胞转录组分析进一步揭示了OCMC-PMBP水凝胶在增殖与重塑阶段调控组织再生的精细机制。对上皮细胞的亚群分析发现,OCMC-PMBP治疗显著促进了基底细胞的增殖与迁移能力,并上调了细胞粘附与连接相关基因的表达(图6d,e),这表明水凝胶通过增强上皮细胞的再生能力加速了屏障修复进程。
在基质重塑方面,成纤维细胞的动态分析显示,PBS组的成纤维细胞反应迟缓且持续表现为炎症表型,而OCMC-PMBP组则能更早地激活增殖型和基质型成纤维细胞(图6f-h),为组织修复提供了必要的细胞基础。关键的机制在于,OCMC-PMBP在增殖期将巨噬细胞的主导表型从促炎状态转变为抗炎状态(图6i,j),进而引发了细胞互作网络的根本性转变。
细胞通讯分析证实,PBS组中促炎巨噬细胞主要通过维持与上皮细胞的相互作用而延续炎症环境;而在OCMC-PMBP治疗组中,抗炎巨噬细胞则与成纤维细胞(特别是基质成纤维细胞)建立了更强的连接,通过Spp1-Cd44和Tgfb1-Tgfbr1等特定的配体-受体对(图6k,l),有效促进了胶原沉积与组织重塑。图6m系统总结了这一从“促炎-上皮互作”到“抗炎-成纤维互作”的关键切换机制,完整揭示了水凝胶协调免疫细胞与组织效应细胞共同推动再生进程的细胞分子基础。
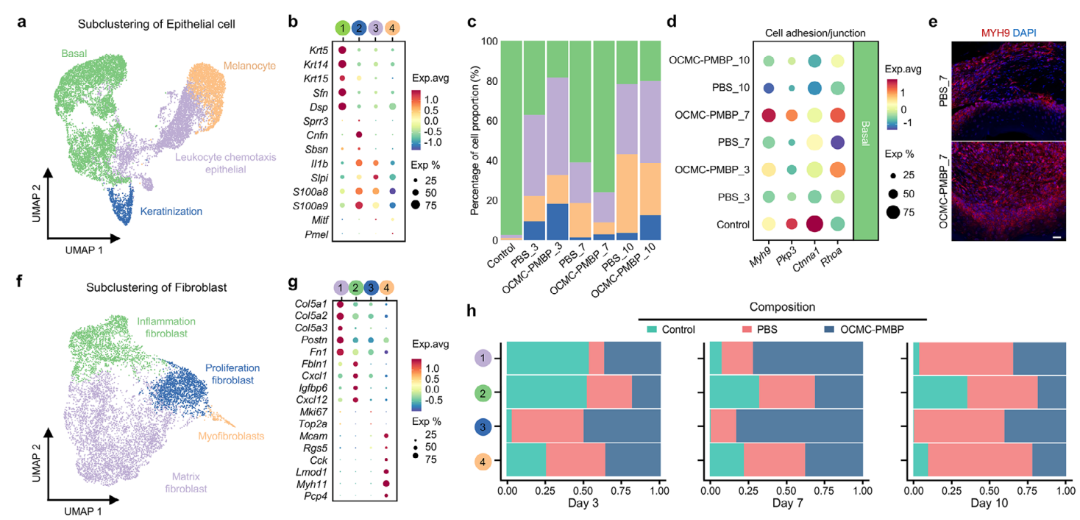
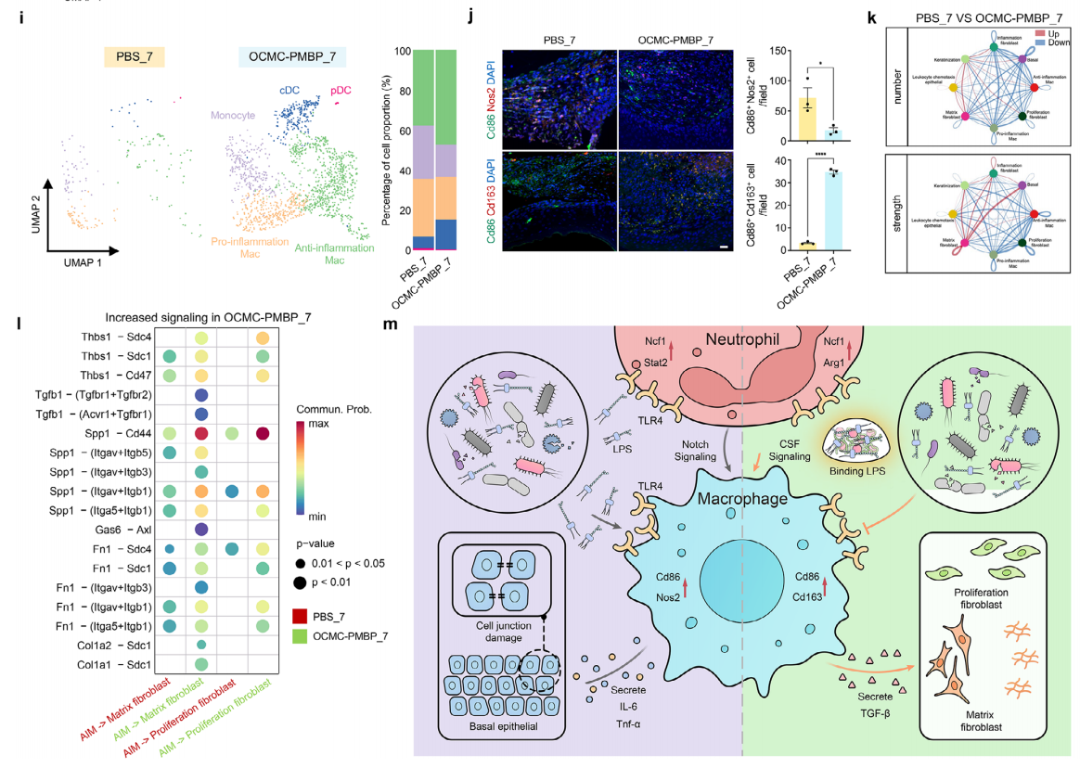
图6. LPS结合水凝胶在增殖与重塑阶段调控巨噬细胞-效应细胞相互作用
研究结论
本研究成功开发了一种兼具抗菌与免疫调节功能的OCMC-PMBP水凝胶。它通过多粘菌素B裂解革兰氏阴性菌释放LPS,并利用聚乙烯亚胺高效捕获LPS,从源头阻断其激活TLR4信号通路。应用于口腔-鼻腔穿孔伤口,该水凝胶不仅能清除LPS、恢复菌群平衡,更重要的是通过单细胞转录组学证实,它能重编程免疫微环境:抑制中性粒细胞和巨噬细胞的促炎表型,促进其向抗炎/再生表型转化,并优化巨噬细胞与上皮细胞、成纤维细胞的互作,从而将炎症环境转向促修复状态,最终显著加速黏膜伤口的再生与愈合。
参考文献:
https://doi.org/10.1002/adma.202514484






