前言
2025年11月26日,华中科技大学同济医学院附属协和医院心血管外科团队在Bioactive Materials期刊上发表了题为“Dual itaconate delivery systems modulate macrophage Acod1-Hif-1α-glycolysis axis for immunotherapy of bioprosthetic heart valve calcification”的研究论文,系统性地探究了生物瓣膜钙化的免疫代谢机制,并提出了两种基于衣康酸(itaconate)递送的免疫治疗策略,为BHV管理中的先进免疫调节治疗开辟了新途径。

发表期刊:Bioactive Materials
影响因子:20.3
涉及的欧易生物服务产品:单细胞转录组测序、空间转录组
研究背景
心脏瓣膜病(VHD)是全球范围内的重大健康问题,瓣膜置换术是VHD的主要治疗手段,生物瓣膜(BHV)因其无需人工心脏瓣膜而备受青睐,但BHV植入后常发生钙化等结构性瓣膜退化,目前仍缺乏有效治疗方法。近年研究提示免疫反应(尤其是巨噬细胞)在钙化中起关键调节作用,但具体的免疫机制不明确则阻碍了靶向疗法的开发。
研究内容
本研究通过单细胞测序(scRNA-seq)和空间转录组学(ST-seq)技术,对临床样本和小鼠模型样本进行分析,绘制了免疫细胞的时空动态图谱及与BHV钙化相关的转录特征。其次,作者通过细胞实验和基因敲除(KO)小鼠模型,明确了不同免疫缺陷小鼠中的关键免疫细胞类型,并探究了钙化相关亚群及其特定作用。基于揭示的机制,作者设计了两种治疗BHV钙化的策略:局部缓释系统和靶向BHV的纳米颗粒递送系统,两者均展现出卓越性能,具有显著的临床转化潜力。
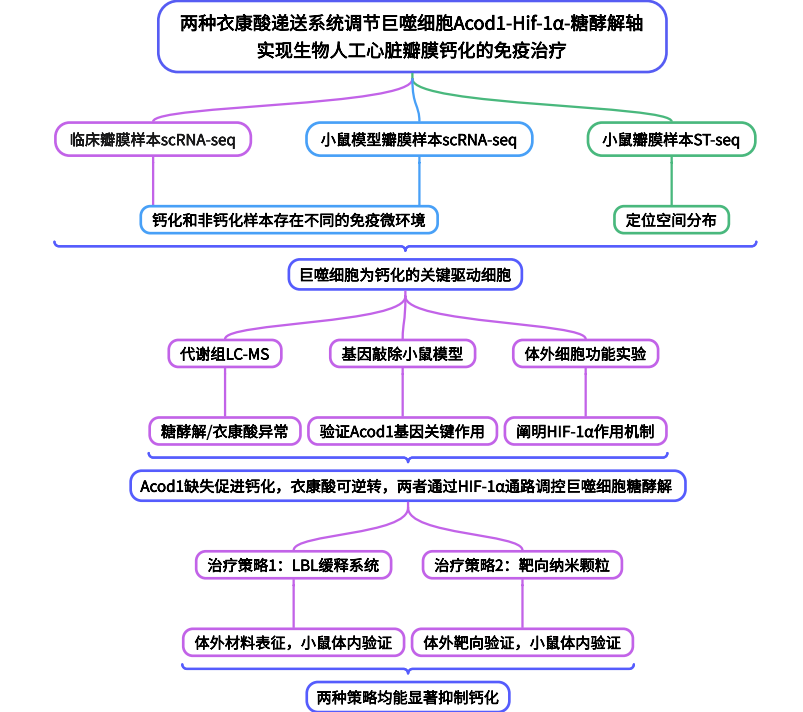
研究结果
Result1 临床BHV标本显示cBHV与ncBHV之间的免疫景观存在显著差异
对两名患者钙化(cBHV)与非钙化(ncBHV)的瓣膜样本进行了scRNA-seq(图1A、B)。结果显示cBHV样本中的巨噬和T/NK细胞占比显著高于ncBHV组(图1C、D)。接着用免疫荧光染色证实巨噬细胞是主要浸润的免疫细胞,T、B细胞浸润比例较低(图1E),表明免疫细胞尤其是巨噬细胞浸润可能参与了BHV钙化过程。KEGG与GSVA富集分析显示,钙化瓣膜中的巨噬细胞大类及亚群主要富集于凋亡、氧化应激、代谢重编程等通路,提示其促炎、促钙化表型(图1F-L),TNK亚群则主要与细胞毒性、炎症和缺氧适应相关(图1M–O)。这些结果表明,cBHV与ncBHV在免疫组成和功能状态上存在显著差异:钙化瓣膜主要由代谢应激、促炎性巨噬细胞和 TNK 亚群主导,而非钙化瓣膜则保持免疫调节和稳态特征。
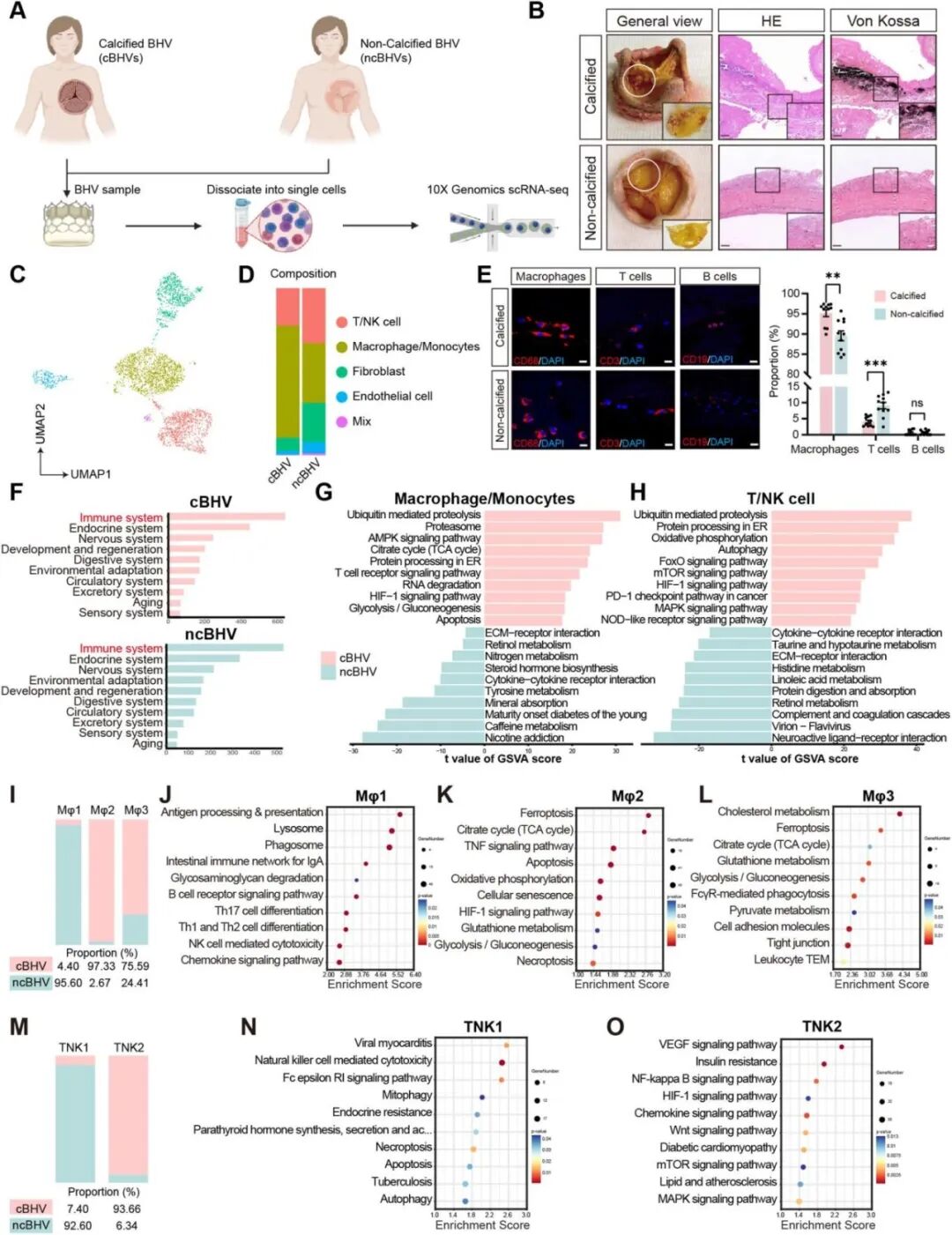
图1. 临床BHV样本显示钙化与非钙化瓣膜的免疫景观差异
Result 2 小鼠模型中巨噬细胞是BHV钙化的关键免疫细胞
进一步用小鼠皮下植入模型来检测钙化并评估生物材料诱导的免疫反应(图2A),对小鼠皮下植入后2周(早期轻度钙化)和4周(晚期重度钙化)的组织进行了scRNA-seq(n=3),相关性分析显示小鼠与临床scRNA-seq数据具有高度一致性(图2D),类似地,在小鼠模型中,BHV组浸润的巨噬细胞显著增加,且随时间推移比例上升(图2E-J)。在多种免疫缺陷小鼠模型中继续阐明免疫细胞在BHV钙化中的作用,发现裸鼠(Rag2-/-)和T/B细胞缺陷小鼠中,BHV钙化与野生型无显著差异,表明T/B细胞不是钙化必需的(图2K-L);而在清除巨噬细胞的C57BL/6和 BALB /c小鼠中,BHV钙化则显著减少,表明巨噬细胞在钙化中具有关键作用(图2M、N)。
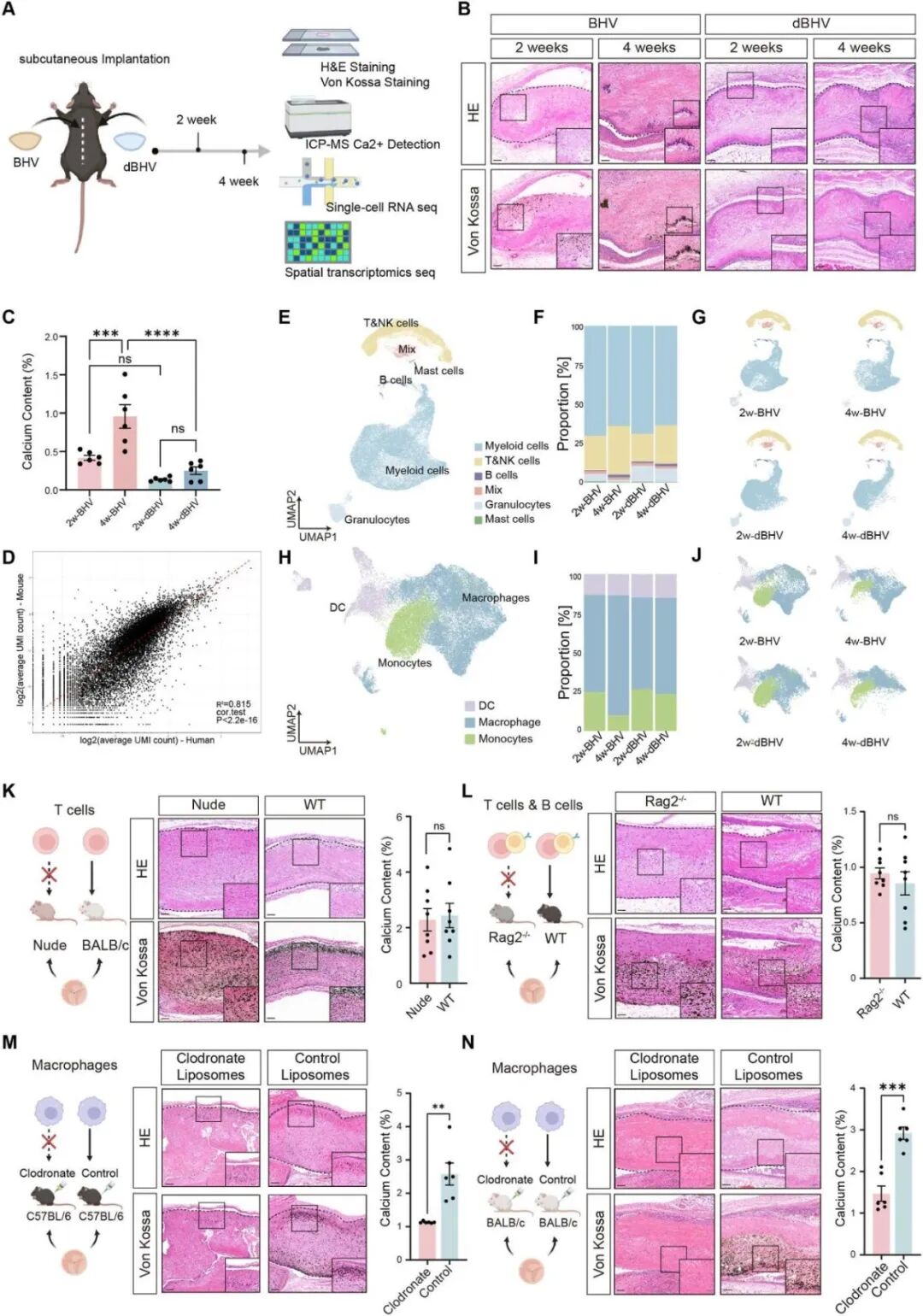
图2. 巨噬细胞在BHV钙化过程中发挥关键作用
Result 3 空间转录组揭示BHV钙化的病理进程
对植入后2周和4周获取的BHV瓣膜和dBHV瓣膜进行空间转录组测序(ST-seq)继续探究BHV钙化的病理进程(图3A),结果显示巨噬细胞是不同瓣膜区域的主要细胞类型(图3B、C),表明巨噬细胞积极参与BHV钙化的起始和进展过程。Monocle2拟时序分析结果显示钙化发展轨迹是从2周钙化区→2周非钙化区→4周钙化区→4周非钙化区,表明BHV钙化的渐进性和阶段性特征(图3D)。深入探究拟时序不同阶段的转录变化,共识别出四个明显阶段,不同阶段高变基因富集分析结果提示随钙化进展出现凋亡、氧化应激、ECM紊乱等功能特征(图3E-I),这些结果揭示了BHV钙化与巨噬细胞凋亡、氧化应激及细胞外基质重塑功能障碍之间的潜在关联。免疫荧光实验显示BHV组中凋亡巨噬细胞、氧化应激增加,胶原产生减少(图3J-O)。
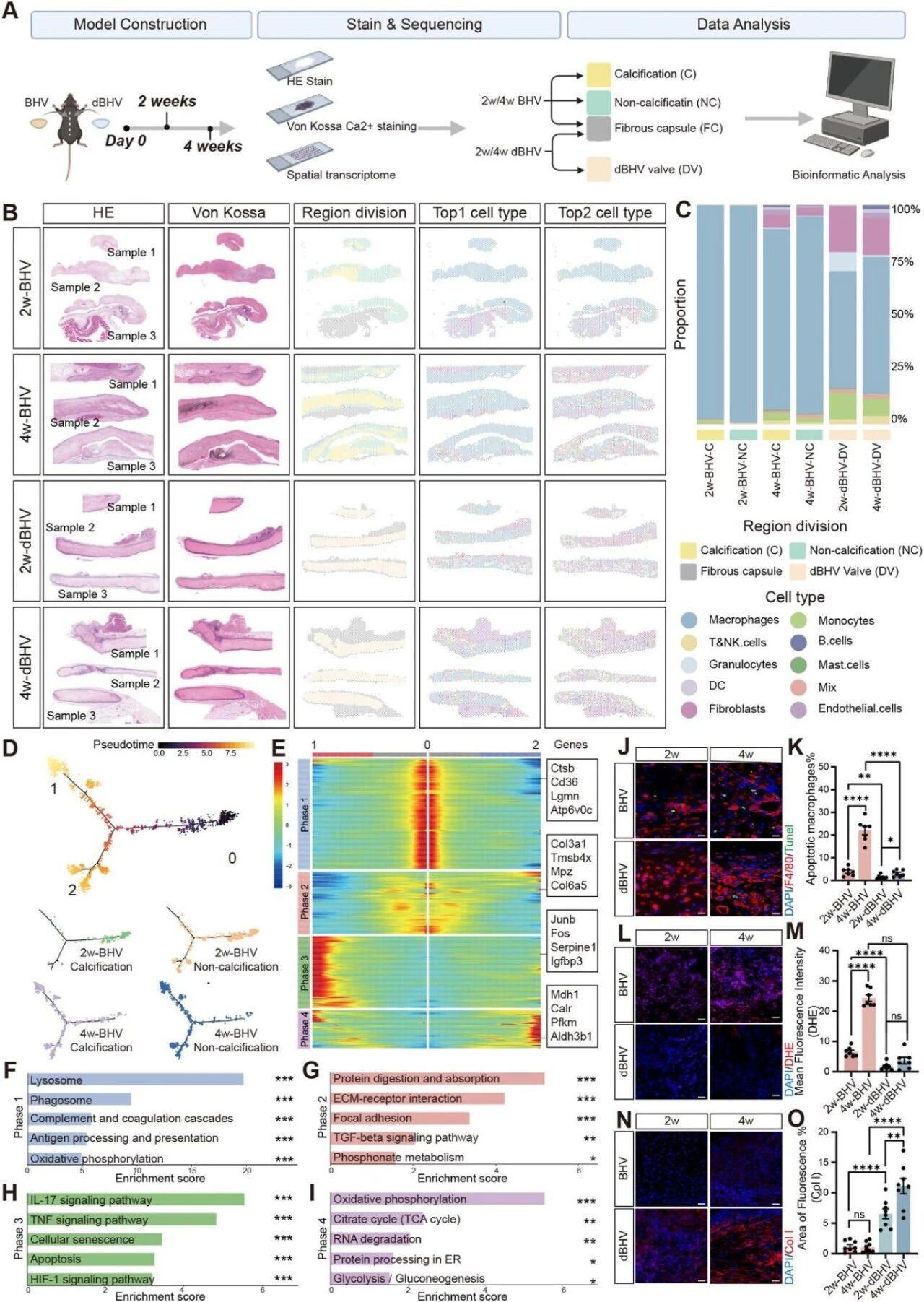
图3. ST-seq揭示BHV钙化病理过程
Result 4 BHV钙化与巨噬细胞糖酵解及Acod1/衣康酸下调相关
为阐明巨噬细胞在BHV钙化过程中的复杂动态作用,继续对小鼠单细胞数据进行亚群分析,共鉴定出三种不同的巨噬细胞亚群:Mac1、Mac2和Mac3(图4A),其中Mac2在BHV中比例随时间增加,而Mac1则呈相反变化趋势,并在dBHV中占主导地位(图4B),ST-seq数据则验证了这些发现:Mac1主要分布于dBHV瓣膜区域,而Mac2则聚集在 BHV 区域,尤其在钙化部位,Mac3在所有组别中分布稀疏(图4C)。空转GSVA分析结果显示Mac1与免疫相关疾病的关联,Mac2表现出糖酵解代谢状态,Mac3在细胞周期和DNA复制通路中富集,反映其增殖表型(图4D)。对临床样本的巨噬细胞进行拟时序分析,同样显示巨噬细胞从抗钙化表型向促钙化表型转变伴随糖酵解活性增强(图4E),LC-MS靶向代谢组学也显示BHV组中糖酵解中间产物积累(图4F),表明代谢重编程与BHV钙化密切相关。韦恩分析结果鉴定了20个可能驱动BHV钙化的关键基因(图4G),鉴于以往研究中Acod1/衣康酸轴在调节免疫应答及调控巨噬细胞糖酵解中的关键作用,在本次数据中,Acod1基因在Mac1中表达升高,而在Mac2中表达极低(图4H),代谢组结果显示衣康酸水平在BHV组下降,流式、免疫荧光结果也证明Acod1在促钙化巨噬细胞(Mac2)中低表达,在BHV组巨噬细胞中表达降低,因此Acod1被选为重点研究对象。
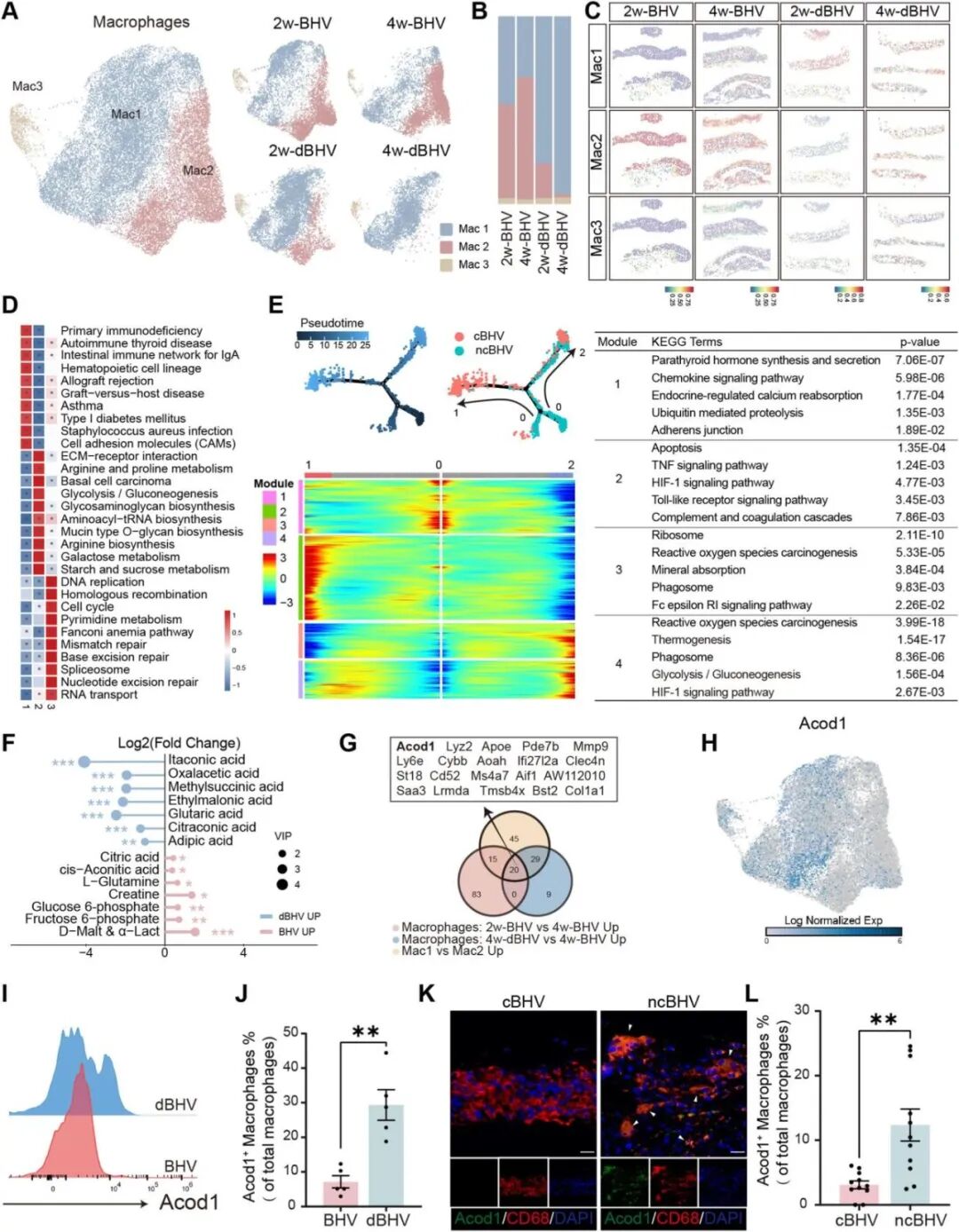
图4. BHV钙化与巨噬细胞糖酵解及Acod1/衣康酸下调相关
Result 5 Acod1缺失促进钙化,衣康酸可逆转
用Acod1基因敲除小鼠继续探究Acod1对BHV钙化的影响,发现Acod1敲除小鼠和巨噬细胞特异性Acod1敲除小鼠中的BHV钙化加剧,衣康酸衍生物4-OI治疗可减轻钙化(图5A-D),表明Acod1/衣康酸轴在巨噬细胞介导的BHV钙化中的关键作用,并提示靶向该通路可能延缓钙化进展。随后检测巨噬细胞中Acod1缺失的功能影响,发现Acod1基因敲除显著增加了巨噬细胞的比例,该效应同样可被4-OI处理逆转(图5E)。体外体内实验均发现Acod1缺失可导致巨噬细胞凋亡增加、氧化应激增强、ECM修复能力下降、侵袭能力减弱,这些表型均可被4-OI逆转(图F-J)。
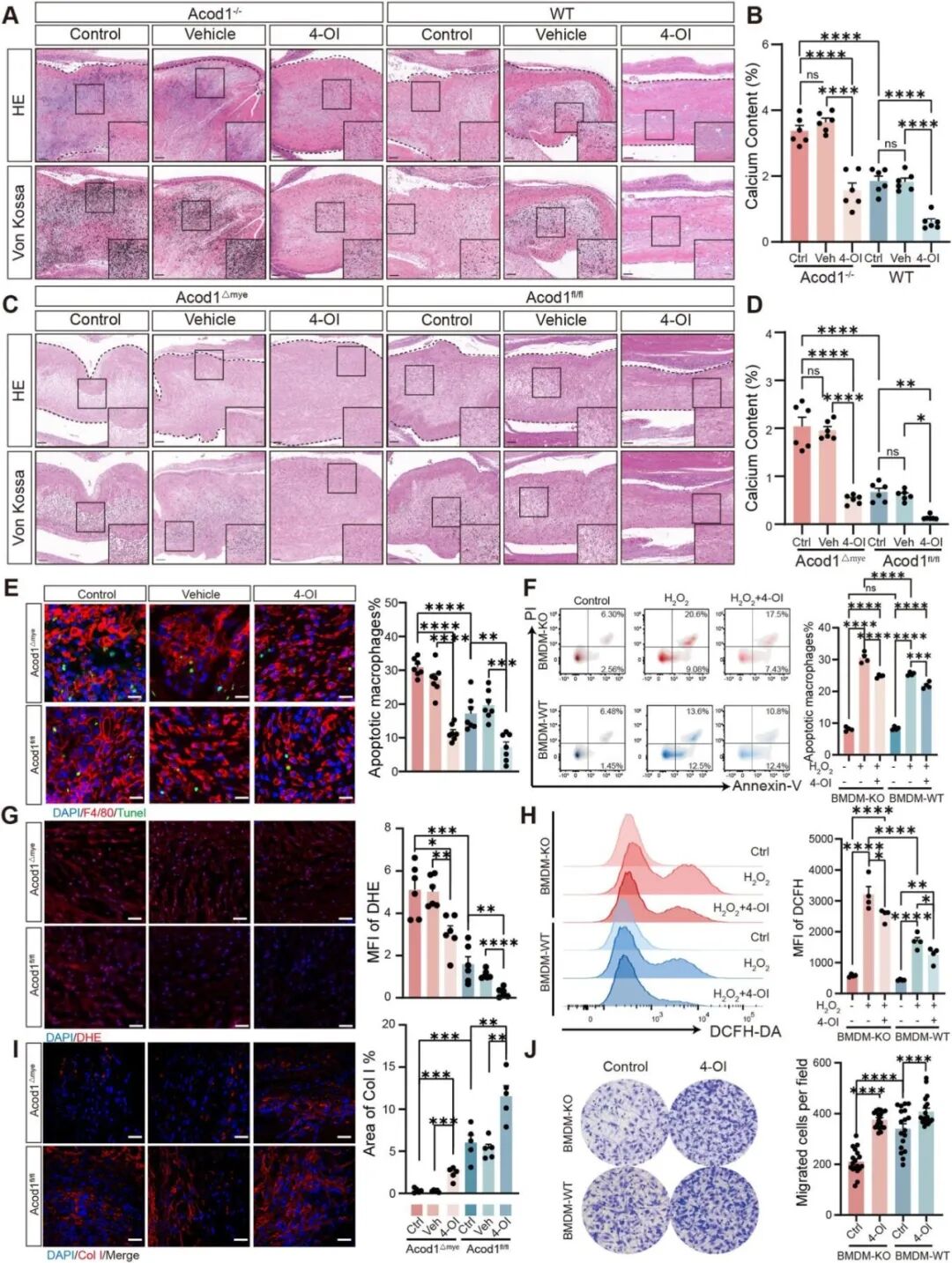
图5. Acod1/衣康酸缺失通过巨噬细胞功能障碍促进BHV钙化
Result 6 Acod1/衣康酸通过Hif-1α通路调控巨噬细胞糖酵解
线粒体压力测试和糖酵解压力测试显示Acod1缺失巨噬细胞氧化磷酸化降低、糖酵解增强,4-OI可部分逆转(图6A-F),为阐明Acod1在糖酵解活性介导的钙化中的作用,用糖酵解抑制剂2-DG处理骨髓来源巨噬细胞(BMDMs),发现2-DG可减少Acod1缺失巨噬细胞的凋亡和氧化应激(图6G-I),表明Acod1通过调节糖酵解影响细胞对氧化应激的反应。进一步对过氧化氢刺激下培养的 BMDM -KO和 BMDM -WT细胞进行RNA-seq以深入解析Acod1/衣康酸调控糖酵解的具体机制,GSVA分析显示Hif-1α信号通路在Acod1缺失巨噬细胞中显著上调(图6J),流式细胞术结果也证实Acod1缺失巨噬细胞中Hif-1α表达升高,4-OI可降低其表达(图6K)。Hif-1α抑制剂KC7F2可逆转Acod1缺失巨噬细胞的凋亡、氧化应激、侵袭能力异常和糖酵解表型(图6L-T),表明Acod1/衣康酸轴通过抑制Hif-1α 的表达来调控巨噬细胞促钙化相关功能。
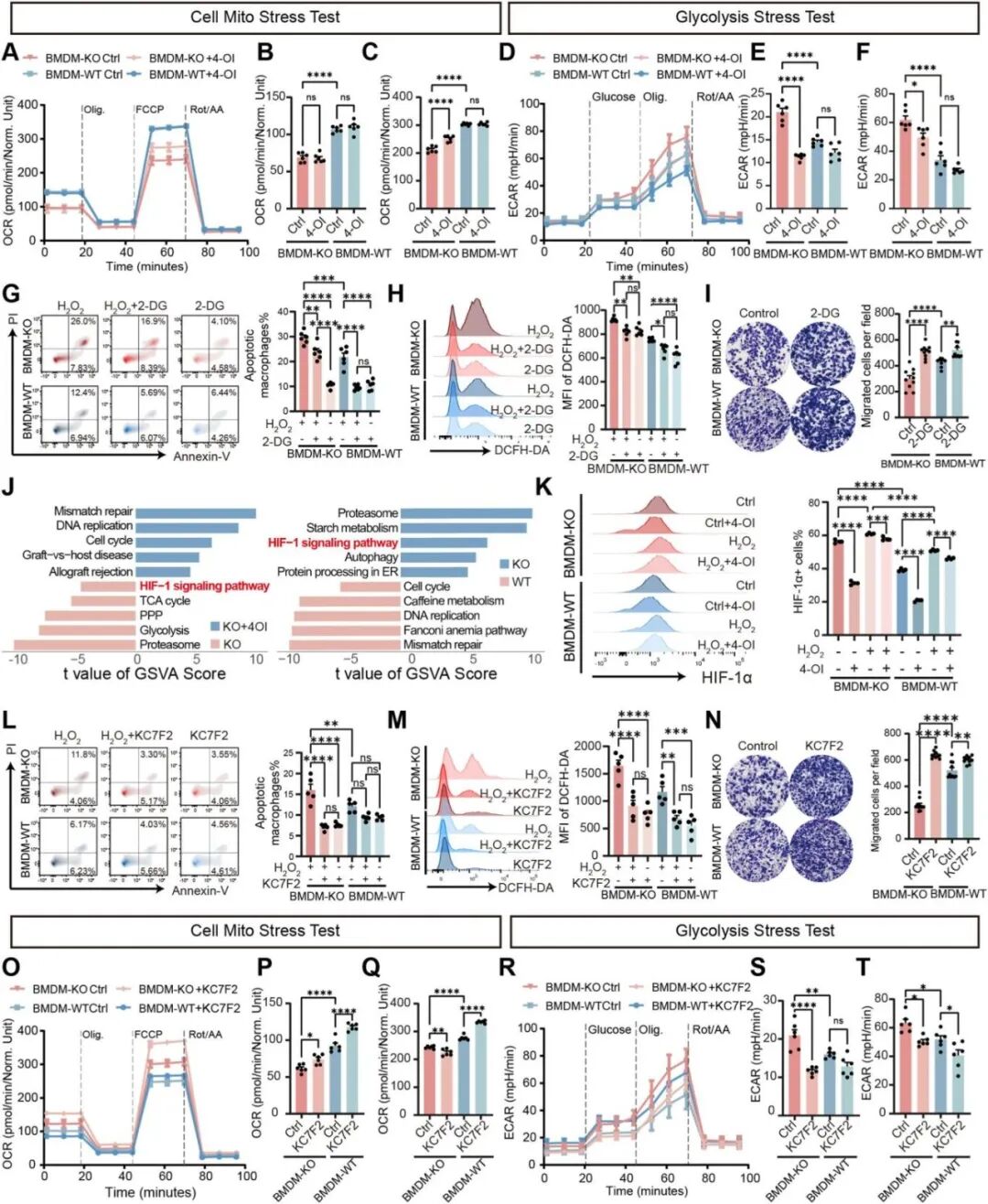
图6. Acod1通过Hif-1α调控糖酵解影响巨噬细胞功能
Result 7 两种衣康酸递送系统均能显著抑制钙化
为提高药物利用率并维持局部高浓度,作者采用逐层(LBL)自组装技术开发了一种局部缓释衣康酸系统:BHV依次浸泡在PDA和ITA溶液中,形成多层涂层(图7A-E),随后通过体外细胞相容性测试表明ITA组细胞毒性低、氧化应激减少(图7F-I),小鼠体内实验显示ITA修饰BHV钙化减轻、巨噬细胞凋亡减少、氧化应激降低、胶原产生增加(图7J-Q),这些结果表明ITA修饰的BHV表现出优异的抗钙化特性与细胞相容性,完全符合临床应用的基本标准。
为突破局部缓释系统单一给药模式和缺乏补给机制的瓶颈,作者创新性地开发出另外一种基于生物正交点击化学的BHV靶向纳米颗粒递送系统,该系统通过BHV表面修饰了TCO基团,而4OI负载的纳米颗粒则带有Tz基团(4OI@Tz-NP),当静脉注射4OI@Tz-NP时,TCO与Tz基团会发生生物正交反应,使纳米颗粒能特异性结合 BHV -TCO表面(图8A)。随后用体内外靶向实验证实二者的特异性结合和精准递送4-OI至BHV,治疗实验也表明该递送系统可实现强效抗钙化效果,改善巨噬细胞功能和ECM修复(图8G)。
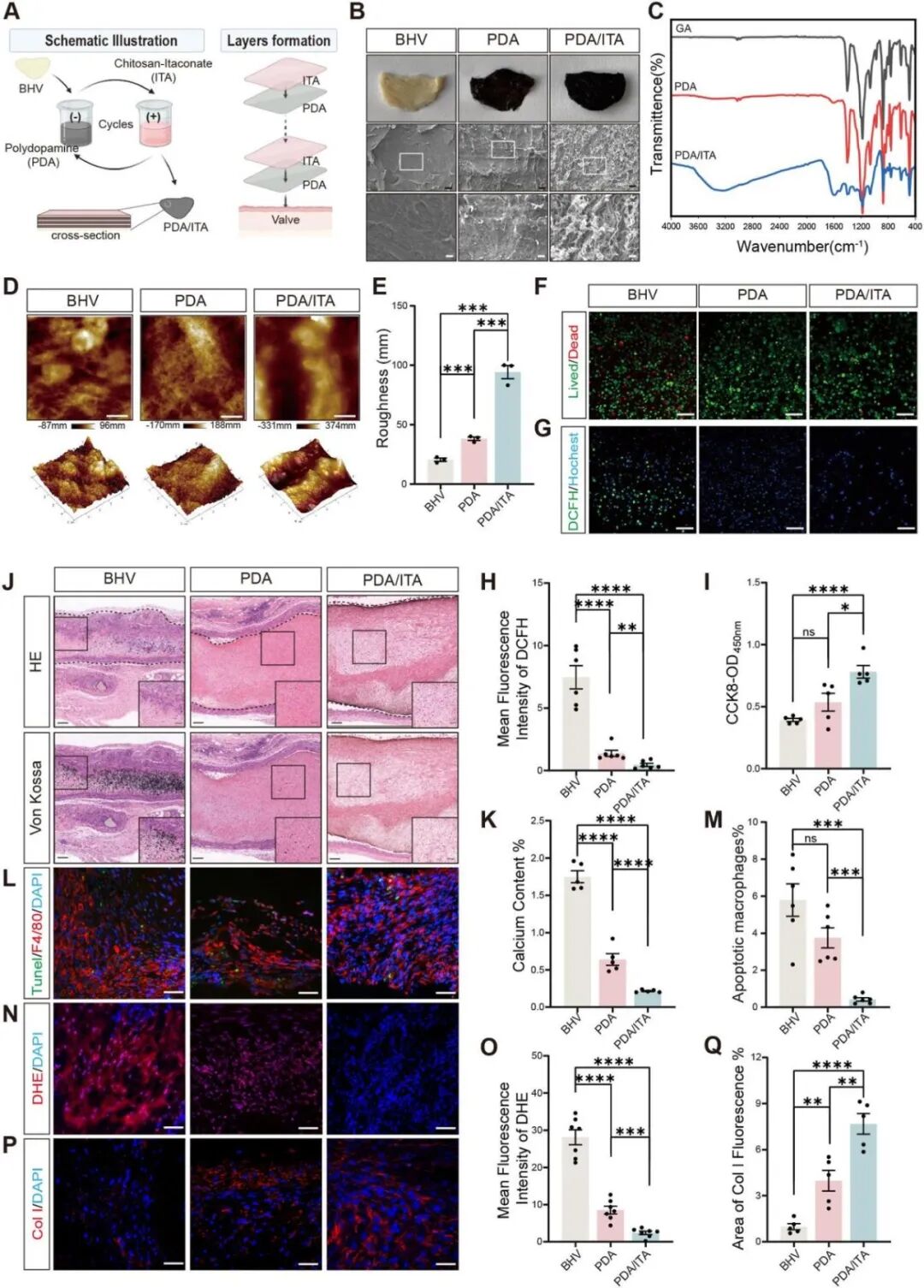
图7. LBL组装修饰的衣康酸缓释系统具有抗钙化效果
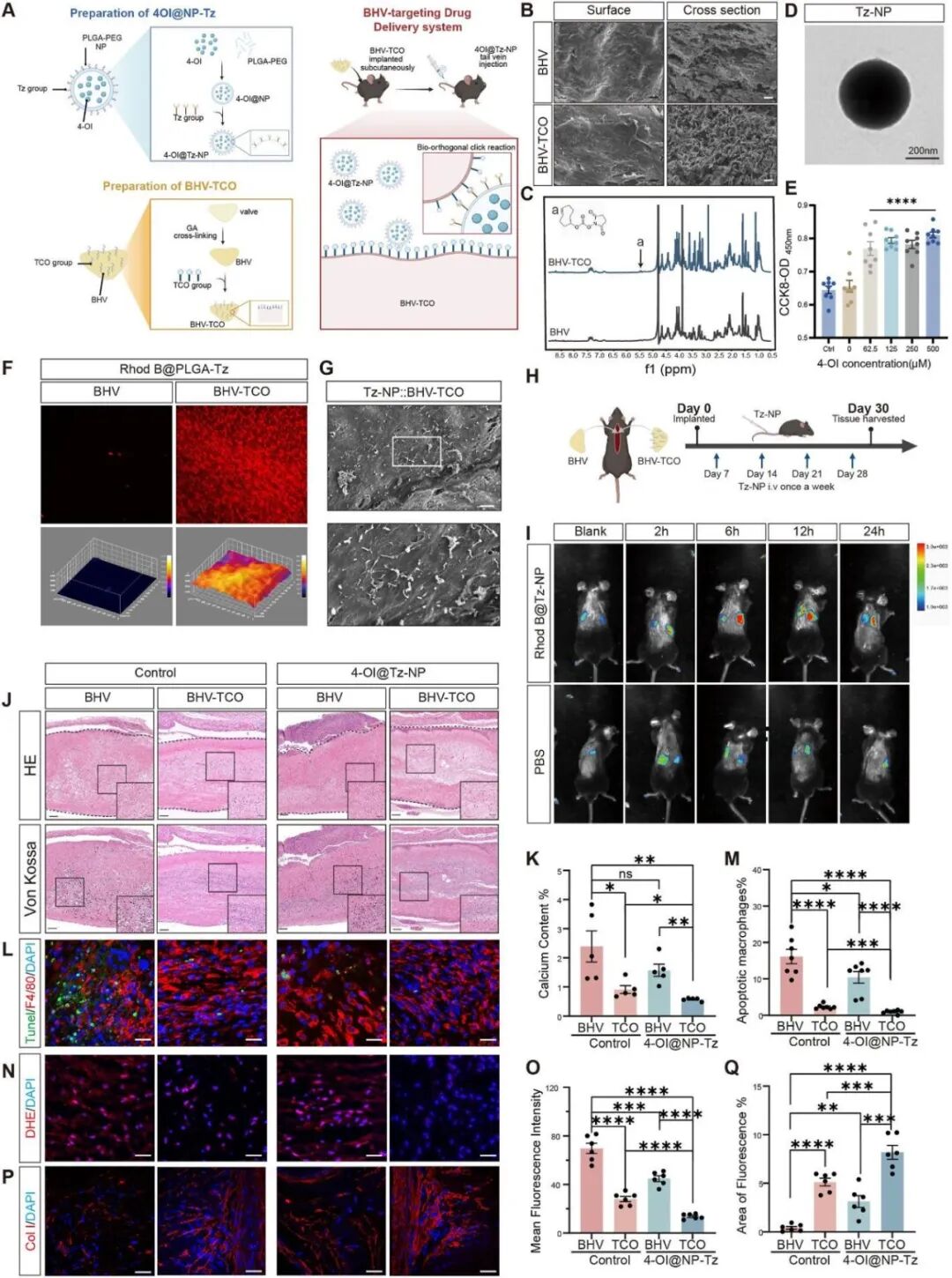
图8. 基于生物正交点击化学的BHV靶向纳米颗粒递送系统具有强效抗钙化效果
研究结论
本研究通过全面的scRNA-seq和ST-seq技术,首次系统解释了BHV钙化的时空调控机制:巨噬细胞中 Acod1–衣康酸–Hif-1α–糖酵解轴在BHV钙化中具有核心作用,而基于该机制研究结果,作者开发了局部缓释衣康酸的系统及BHV靶向纳米颗粒递送系统都具有显著抗钙化效果。为BHV钙化发病机制中的免疫反应提供了重要见解,表明靶向Acod1low巨噬细胞可能是早期干预BHV 钙化与退行性病变的有效策略。
参考文献:
https://doi.org/10.1016/j.bioactmat.2025.11.040






