2025年12月8日,空军军医大学牛丽娜团队在Nature Communications在线发表了题为“Metabolic support protects mucosa from ferroptosis in radiation-induced mucositis”的论文。本研究发现放射性黏膜损伤中,铁死亡是辐射诱导口腔黏膜上皮细胞死亡的主要方式,STA1-ACSL4轴是调控铁死亡的核心通路;辐射早期成纤维细胞通过HIF-1α-ODC1轴合成多胺,以旁分泌方式为基底细胞提供代谢支持,通过JunD-SAT1-ACSL4轴抑制铁死亡,构成机体自我保护机制,为RIOM的预防和治疗提供了新的靶点。欧易生物提供了单细胞转录组的测序工作。

发表期刊:Nature Communications
影响因子:15.7
涉及的欧易生物服务产品:单细胞转录组测序
研究背景
电离辐射是癌症治疗的有效手段,但会引发辐射诱导的口腔黏膜炎(RIOM)等并发症。以往研究表明,辐射诱导的口腔黏膜炎表现为黏膜萎缩或溃疡,伴随剧烈疼痛和屏障功能受损,这些症状主要由电离辐射导致的上皮细胞死亡引起。然而,抗凋亡药物在治疗辐射诱导的口腔黏膜炎方面临床疗效有限,提示可能存在其他细胞死亡方式参与疾病进展。铁死亡作为一种铁依赖性、脂质过氧化物积累驱动的新型细胞死亡方式,近年被证实与多种应激损伤相关,但其在RIOM中的作用及调控机制尚未明确。因此,深入探究铁死亡在RIOM中的死亡机制,对于开发靶向治疗方案至关重要。
研究内容
本研究通过单细胞测序发现,铁死亡是口腔黏膜炎上皮细胞耗竭的主要细胞死亡方式,并通过构建动物模型以及多种共培养体外实验发现,辐射暴露早期存在代偿阶段,成纤维细胞会提供关键的代谢支持,研究证实,补充多胺能有效预防黏膜损伤。这些发现揭示了成纤维细胞介导的代谢支持在保护口腔黏膜免受辐射损伤中的关键作用,为增强机体抵御辐射相关疾病的内在保护机制提供了新的思路。
技术路线

研究结果
1. 电离辐射对上皮细胞稳态的影响
通过口腔黏膜炎患者舌活检组织和辐射诱导的小鼠黏膜炎的舌样本的HE染色和免疫荧光染色发现,人和小鼠舌组织的上皮明显变薄,基底细胞增殖能力下降(图1a~h);为探究黏膜的细胞组成变化,作者通过对辐射暴露前后的小鼠舌黏膜进行了单细胞RNA测序,发现辐射暴露导致上皮细胞数量急剧减少,针对上皮细胞进一步亚型分析发现,基底细胞在辐射前后均为上皮细胞的主要亚群(图1i~l),KRT14免疫组化染色证实,辐射后基底细胞数量大幅减少(图1m)。这些结果表明,电离辐射导致口腔黏膜显著变薄,主要原因是上皮细胞(尤其是基底细胞)的大量耗竭。
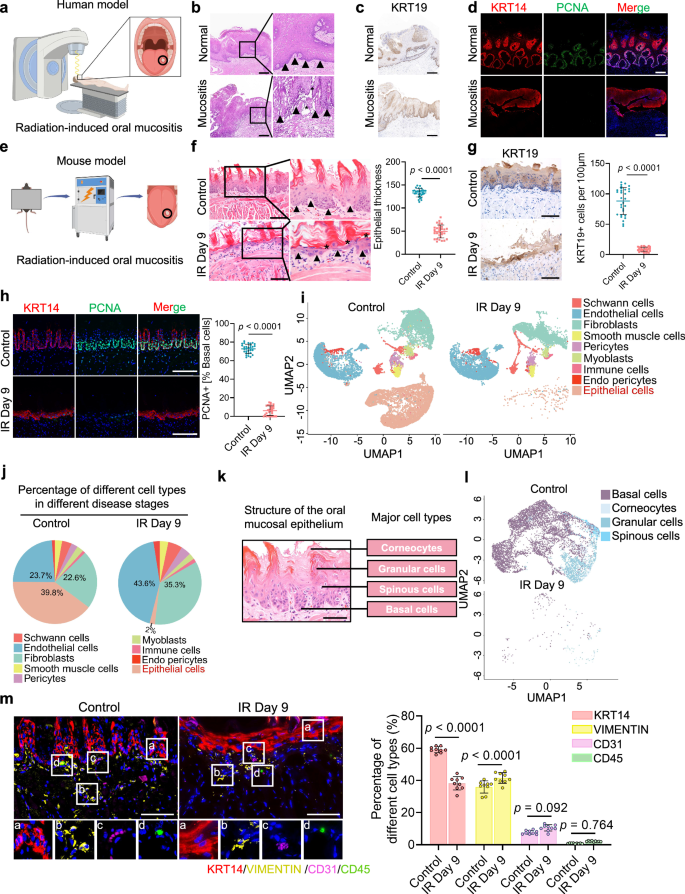
图1 辐射诱导的人类及小鼠舌黏膜上皮变薄与基底细胞耗竭
2. 电离辐射对基底上皮细胞铁死亡的影响
通过用AddModuleScore函数对基底细胞不同死亡途径评分,发现辐射暴露后铁死亡评分显著升高(图2a),免疫荧光发现,铁死亡诱导因子ACSL4在人类口腔黏膜炎病变的基底细胞中显著增加(图2b);通过构建小鼠模型,发现铁死亡抑制剂LIP-1不仅能抑制ACSL4的表达,还能恢复黏膜厚度(图2c~e)。这些结果表明,基底上皮细胞的铁死亡是辐射诱导细胞死亡的主要机制。
3. 辐射诱导的口腔黏膜炎早期潜在保护性代偿作用
作者进一步构建时间梯度小鼠黏膜损伤模型,辐射后早期阶段,基底细胞的铁死亡生物标志物PTGS2的表达未显著增加,而在后期阶段则显著升高(图2f),HE染色显示早期阶段的特征是黏膜厚度增加、基底细胞增殖活跃(图2g);基底细胞的GSVA分析发现,辐射后早期阶段,与有毒物质应答、酶活性和蛋白质折叠相关的过程被激活,且存在抑制凋亡的调控机制,后期阶段,与蛋白质折叠、伤口愈合、细胞间黏附、翻译和基底膜完整性相关的功能则出现下降(图2h)。这些结果显示,辐射诱导的口腔黏膜炎早期存在短暂的保护性应答,表现为代偿性黏膜增厚,以对抗辐射应激。
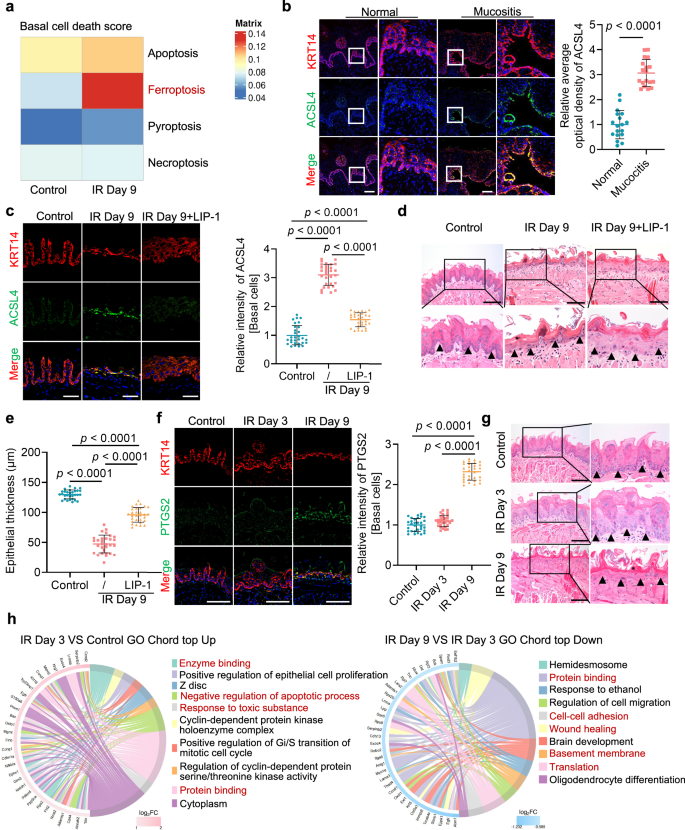
图2 离子辐射诱导基底上皮细胞发生铁死亡
4. 成纤维细胞对基底细胞铁死亡的影响
为探究辐射诱导的口腔黏膜炎早期阶段对基底细胞的保护机制,作者分析了其周围微环境的细胞组成。结果显示,在后期阶段,与基底细胞相邻的成纤维细胞数量显著减少(图3a、b);Cell Chat分析发现,早期阶段成纤维细胞和上皮亚型细胞之间相互作用持续处于高水平,后期则显著减弱(图3c);体外共培养实验发现,在辐射条件下,与成纤维细胞共培养的基底细胞增殖活性显著增强,且细胞内铁水平和脂质过氧化程度均显著下降(图3f~h);这些结果表明,成纤维细胞介导的支持在辐射诱导黏膜损伤的早期代偿性保护基底细胞中发挥关键作用。成纤维细胞时序分析发现,早期阶段,与代谢和上皮保护相关的基因上调,后期阶段则富集了与炎症相关的基因,这与功能富集结果也一致(图3i~j)。这些结果显示,成纤维细胞通过代谢调控在早期为基底细胞提供保护性支持。
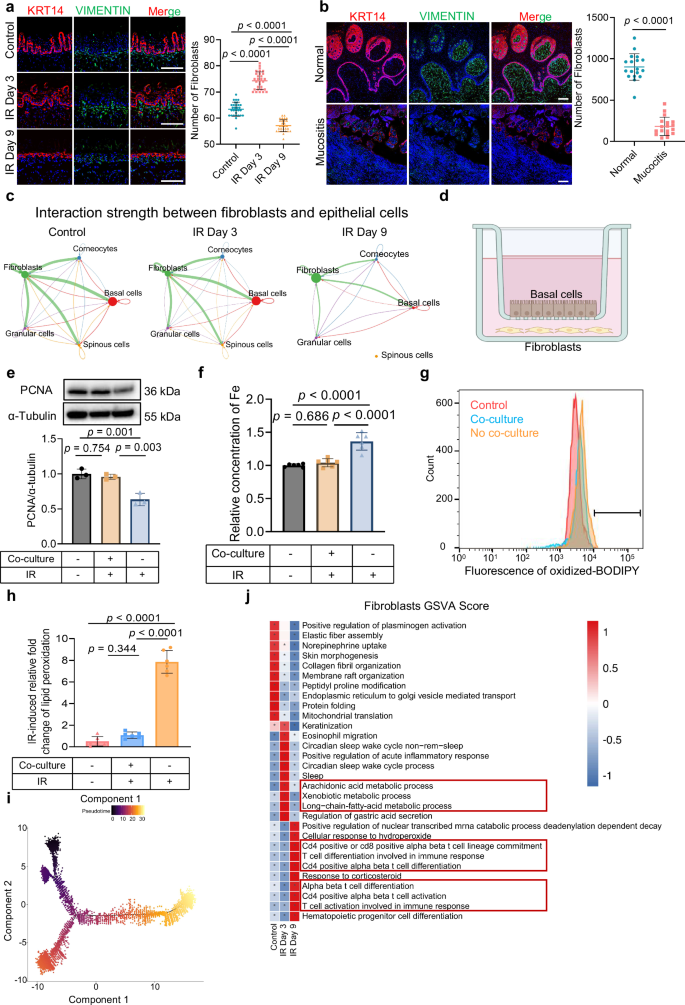
图3 成纤维细胞在辐射诱导性黏膜炎的早期阶段保护基底细胞
5. 成纤维细胞抑制SAT1-ACSL4铁死亡通路的机制
IRDay9组基底细胞中多个与铁死亡相关的基因表达均显著上调,包括SAT1(图4a)。通过共培养实验进一步验证发现,成纤维细胞对SAT1表达的抑制作用最强(图4b),时序共培养实验发现,早期成纤维细胞具有快速且短暂的保护作用;辐射后期这种保护作用消失,且失代偿状态持续至72小时(图4c);构建SAT1缺陷黏膜炎小鼠发现,其黏膜上皮厚度得以维持,且对辐射诱导的损伤具有抗性,辐射后期,基底细胞仍保持较高的增殖能力(图4d~e);PPI互作发现,ACSL4和SAT1相互作用最强,之后通过细胞实验证实SAT1在ACSL4的上游发挥调控作用(图4f);通过共培养实验发现,与成纤维共培养的基质细胞的ACSL4表达在辐射后初始下降后又反弹,其变化趋势与SAT1一致(图4g)。这些体内外研究结果表明,在辐射诱导的口腔黏膜炎中,成纤维细胞通过抑制SAT1-ACSL4轴,减轻基底细胞的铁死亡,实现早期代偿性保护,后期这种保护机制减弱,导致铁死亡加剧并促进疾病进展。
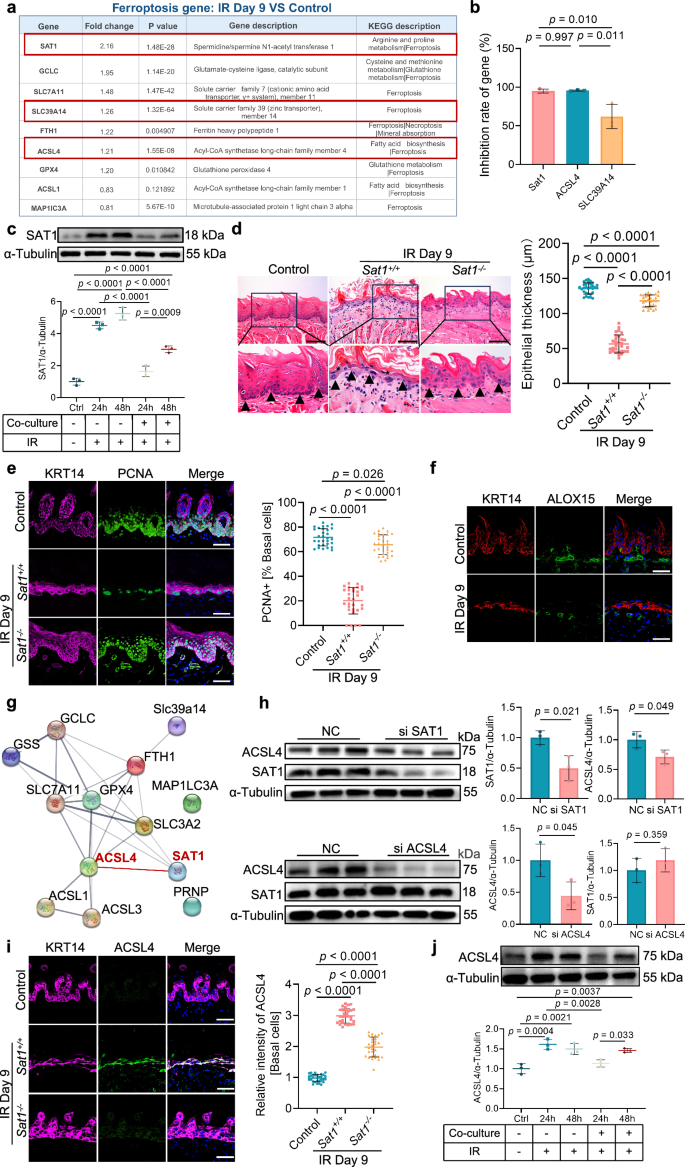
图4 成纤维细胞通过抑制SAT1-ACSL4通路来抑制基底细胞中的铁死亡
6. 成纤维细胞通过动态旁分泌多胺转运维持基底细胞功能
辐射暴露后早期阶段,成纤维细胞的代谢活性增强,且已知其可调控SAT1(图5a),辐射后早期阶段多胺稳态有效维持;后期阶段,这种代偿机制失效,导致亚精胺水平下降(图5b~c)。为进一步探究成纤维细胞与基底细胞之间的多胺动态变化,研究比较了辐射后不同培养条件下的多胺含量。与成纤维细胞共培养的基底细胞,其亚精胺和精胺水平在早期升高,后期则下降(图5d),结果说明,成纤维细胞可作为代谢支持系统,通过分泌新合成的多胺来补充辐射诱导的基底上皮细胞多胺耗竭。
7. 成纤维细胞中ODC1介导的多胺生成可保护基底细胞免受辐射诱导的铁死亡
明确了成纤维细胞的这种支持作用后,研究进一步探究了多胺合成的调控机制。结果发现,辐射暴露后,多胺合成通路中的关键酶ODC1的表达显著上调,免疫荧光也证实这一结果,并且后期成纤维细胞的ODC1显著下调(图5e~f);为直接验证ODC1的功能必要性,构建小鼠舌成纤维细胞中的ODC1敲低模型,组织病理学分析显示,黏膜变薄速度加快(图5g~h);同时,免疫染色和LC-MS分析分别显示,基底细胞和舌成纤维细胞中的多胺水平降低(图5i),这直接将ODC1缺陷与多胺生物合成紊乱关联起来。机制上,这些效应伴随着铁死亡标志物SAT1和ACSL4的表达显著增加(补充图8f~h),这表明成纤维细胞来源的ODC1通过促进多胺生成来抑制基底细胞的铁死亡。体外共培养发现,ODC1敲低则显著降低了精胺浓度,ODC1缺陷的成纤维细胞无法抑制辐射诱导的基底细胞中SAT1和ACSL4的表达(图5j~k)。综上所述,成纤维细胞中ODC1依赖性的多胺生成,通过浓度依赖性调控SAT1-ACSL4轴,保护基底上皮细胞免受辐射诱导的铁死亡。
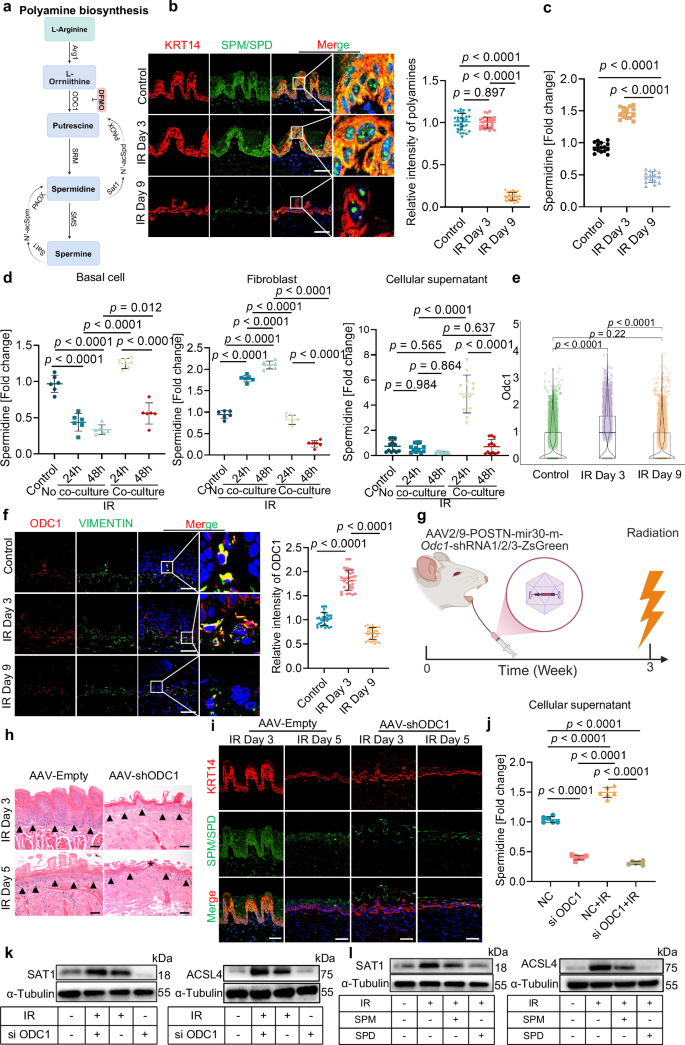
图5 成纤维细胞在辐射后恢复的早期阶段产生多胺,这些多胺可抑制基底细胞的铁死亡
8. 多胺在保护黏膜免受电离辐射诱导损伤中的作用
鉴于亚精胺和精胺在RIOM早期阶段抑制基底细胞铁死亡的能力,作者研究了它们作为预防黏膜炎策略的潜力。构建腹腔注射多胺的辐射小鼠模型,发现多胺补充可在辐射后期阶段有效抑制基底细胞中JunD的激活,这与ACSL4表达降低和铁死亡显著减弱相关(图6a~c);免疫荧光染色证实,辐射后第9天,亚精胺处理组的上皮增殖显著增强,在辐射后期阶段,亚精胺处理使黏膜厚度更大、基底层结构更好、上皮连续性更强(图6d~e);这些发现表明,多胺补充可有效抑制铁死亡、促进基底细胞增殖并维持黏膜完整性,有望成为预防和治疗辐射诱导的口腔黏膜炎的治疗方法。
9. 多胺通过抑制JunD介导的转录调控来抑制基底细胞SAT1-ACSL4铁死亡通路
单细胞数据的SCENIC分析发现,JunD和JunB是调控SAT1的候选转录因子,功能验证显示,破坏其中任一因子都会导致蛋白质复合物不稳定。利用JASPAR数据库对SAT1启动子进行转录因子结合分析,发现在其启动子区域存在JunD结合序列(图6g),随后的ChIP-qPCR证实,JunD在这些位点的富集增加,且辐射暴露后这种富集进一步增强(图6h),干扰JunD会导致SAT1和ACSL4蛋白水平显著下调(图6i)。综上所述,JunD直接调控SAT1的表达,且其激活在基底细胞铁死亡的启动中起关键作用。
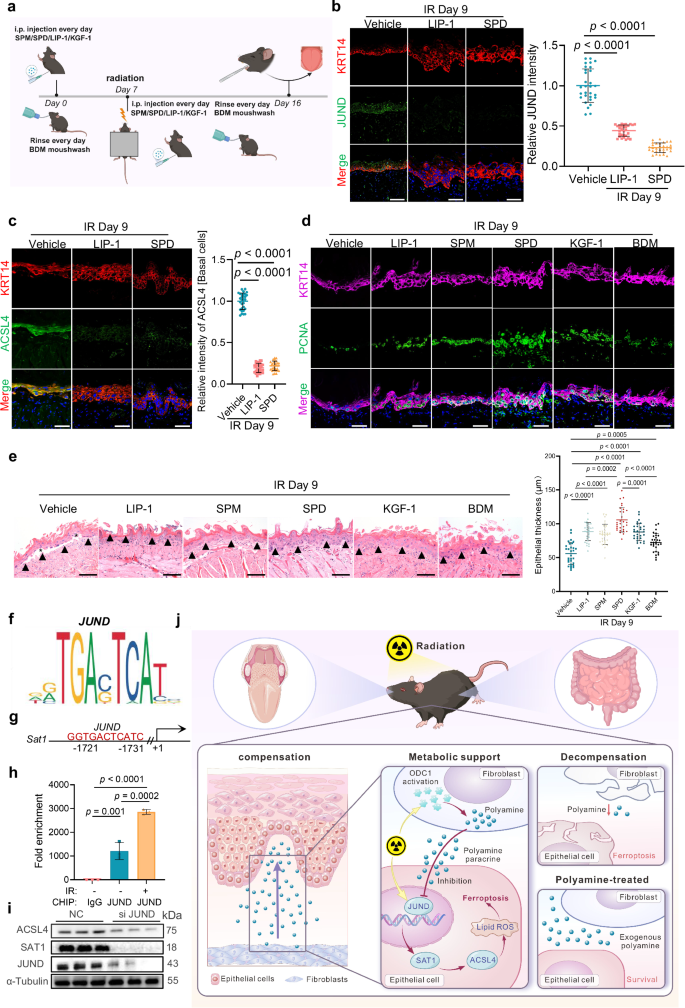
图6 多胺类化合物可抑制铁死亡并逆转基底细胞的黏膜损伤
研究结论
1. 机制层面:铁死亡是辐射诱导口腔黏膜上皮细胞死亡的主要方式,STA1-ACSL4轴是调控铁死亡的核心通路;辐射早期成纤维细胞通过HIF-1α-ODC1轴合成多胺,以旁分泌方式为基底细胞提供代谢支持,通过JunD-SAT1-ACSL4轴抑制铁死亡,构成机体自我保护机制;
2. 治疗层面:外源性补充多胺可模拟内源性代偿机制,能有效预防辐射诱导的口腔黏膜炎,且安全性良好;
3. 临床意义:提出“代谢支持-铁死亡抑制”的新型治疗策略,为优化放疗方案、降低正常组织毒性提供新靶点,尤其为RIOM及多器官辐射损伤的预防和治疗提供了潜在候选药物。
参考文献:
JiangX, ZhaoB, WangT, MaY, LiuW, SunH, LiZ, WangK, HeQ, GuanX, QinL, ShiW, DongY, YeZ, ZhouC, HeX, QingH, LongB, ZhouH, YuZ, JiaoZ. USP20-Driven Cholesterol Metabolism Links Inflammatory Signaling to Malignancy and Stromal Co-evolution in Pancreatic Cancer. Cancer Res.2025 Nov 6. doi:10.1158/0008-5472. CAN-25-1228 IF:16.6 Q1. Epub ahead of print. PMID: 41196022.






