前言
2026年1月2日,徐州医科大学附属医院神经内科崔桂云教授、张勇教授团队联合徐州医科大学肿瘤研究所施明教授团队,在Science Advances (IF=12.5)在线发表题为“BCMA/CD19 CAR T cell therapy for refractory myasthenia gravis: proteomic signatures and single-cell transcriptomics of disease flares”的研究论文。研究团队创新性地设计了靶向BCMA/CD19的双靶点CAR-T细胞,并系统报道了在6例难治性重症肌无力(MG)患者中长达一年的安全性与疗效数据,其中5名患者在6个月时实现无药物缓解,且无严重不良事件。此外,对1例复发患者的单细胞转录组分析进一步将FCRL5识别为复发靶点,其具有进一步在治疗耐受性人群中的转化潜力。欧易生物为单细胞转录组及免疫组库测序及分析提供了技术支持。

发表期刊:Science Advances
影响因子:12.5
涉及的欧易生物服务产品:单细胞5端转录组测序+免疫组库测序
研究背景
重症肌无力(MG)是一种典型的 B 细胞介导自身免疫疾病,临床表现为骨骼肌的波动性无力和疲劳,核心病理是外周耐受崩溃驱动自身反应性B细胞分化为浆细胞,产生靶向神经肌接头(AChR/MuSK等)的致病抗体,导致骨骼肌进行性无力。B细胞耗竭(BCD)疗法是治疗MG的一种有吸引力的治疗策略。嵌合抗原受体T细胞(CAR-T细胞)是经过基因工程改造的T细胞,最新的临床证据表明,工程化的CAR-T细胞通过高效耗尽自身反应性B细胞,重置免疫系统,实现自身免疫疾病的前所未有的缓解,同时保持良好的安全性。但现有的CAR-T疗法多基于单靶点进行改造,仅针对CD19或BCMA不足以全面重置B细胞的致病功能。而本研究首创 BCMA/CD19双靶点CAR-T,实现对B细胞全发育轨迹的源头清除,为根治难治性MG提供了新的范式。
研究内容
研究团队创新性地设计了靶向BCMA/CD19的双靶点CAR-T细胞,对6名难治性MG患者进行了为期一年的综合评估,分析其血清蛋白质组学谱和免疫细胞动态的纵向变化。此外,针对1例治疗后复发的特殊病例,研究者采集其治疗前及治疗后6个月的外周血单个核细胞(PBMCs)和骨髓样本进行了单细胞转录组及免疫组库测序,以阐明潜在复发机制。单细胞测序显示,复发患者的年龄相关B细胞(ABCs)比例升高,且差异基因分析表明,FCRL5表达在ABCs中表达升高,而CAR-T细胞应答者则表现出下调,可能与BCMA/CD19 CAR-T治疗后复发有关,可作为进一步改造CAR-T的靶点。
技术路线
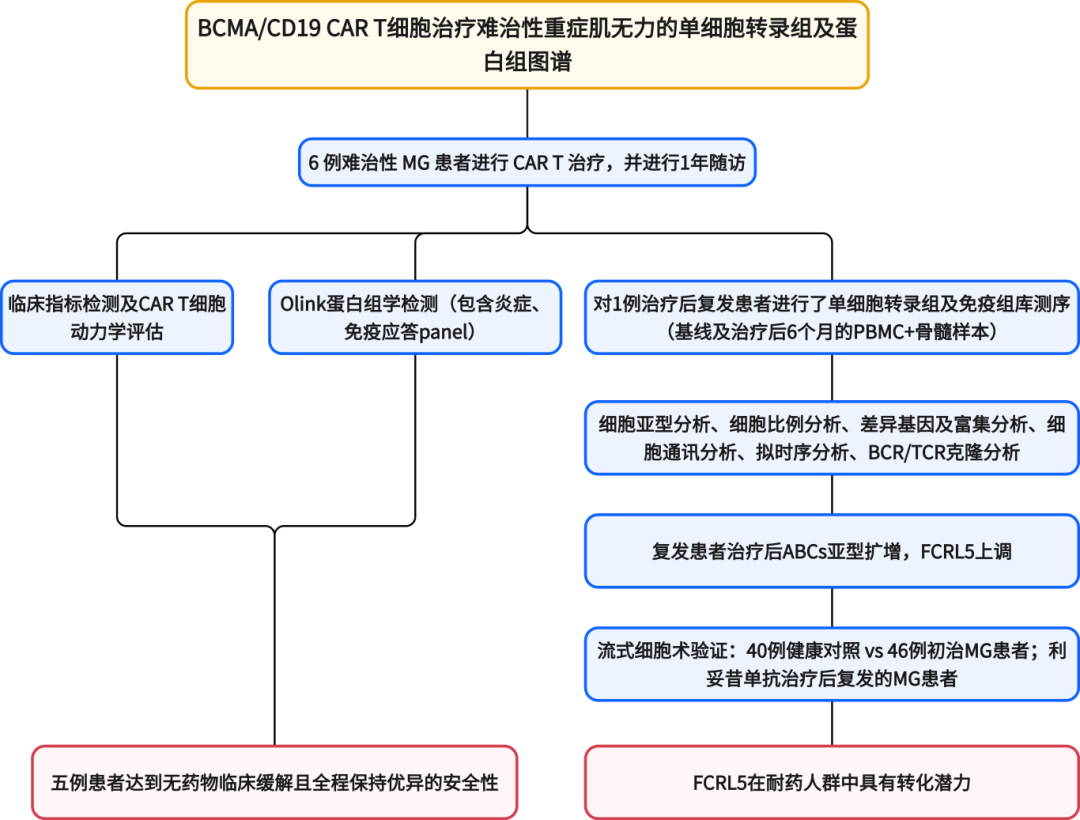
研究结果
Result1 输注后的临床疗效及CAR-T细胞扩增情况
本研究共入组6例MG患者(2例男性和4例女性),此前曾接受多种免疫抑制剂和免疫调节剂治疗,干预后状态显示无变化或恶化,符合难治性MG的标准。BCMA/CD19 CAR-T细胞给药使患者P1至P5在治疗第6个月时均从基线未改善或恶化状态达到最低症状状态(MMS)并停用所有药物(图1H、I);所有患者日常生活能力量表(ADL)评分均为0分,其中P3和P5的定量肌无力评分(QMG)维持在2分,其余三名患者QMG评分完全恢复正常(0分)。延长随访至12个月时,所有患者均维持无临床症状且无需药物的持续缓解状态(QMG=0分,ADL=0分)(图1B、C)。血清学分析显示P1、P2和P5的AChR抗体血清学转阴,而P3和P4分别检出临界滴度抗体(0.7 nM与0.86 nM)(图1D)。CAR-T细胞输注后第14天所有患者均实现完全性外周B细胞耗竭(BCD),B细胞重建(BCRC)时间分别为:P1第180天、P3第270天、P4第60天、P5第90天,但P2至第360天仍未实现重建(图1K);同时全队列血清可溶性B细胞成熟抗原(sBCMA)水平在30天内持续下降(图1L)。所有患者在CAR-T治疗后60天内均出现免疫球蛋白G(IgG)、免疫球蛋白A(IgA)和免疫球蛋白M(IgM)水平下降(图1E-G)。
患者P6在CAR-T细胞输注后180天内表现出持续临床改善,QMG从16分降至5分,ADL评分从12分降至3分(图1B、C)。BCRC发生于第180天(图1K)。AChR抗体滴度在第90天降至0.01 nM,第180天轻微回升至0.33 nM但仍低于诊断阈值(图1D)。然而,第187天观察到疾病复发(ADL评分升至6分)。至12个月随访时,ADL评分从第180天的3分升至最高7分,但仍显著低于基线值12分(图1C)。
体外工艺验证显示CAR-T细胞产品的转导效率稳定维持在53%至73%(图1J)。输注后CAR-T细胞呈现快速扩增动力学,所有6例患者均在约第14天达峰,随后迅速回缩(图1M、N)。同步免疫表型分析揭示体内分化趋向中央记忆T细胞亚群(图S1B),表明其具备淋巴器官归巢与组织穿透能力,这对维持长期疗效至关重要。
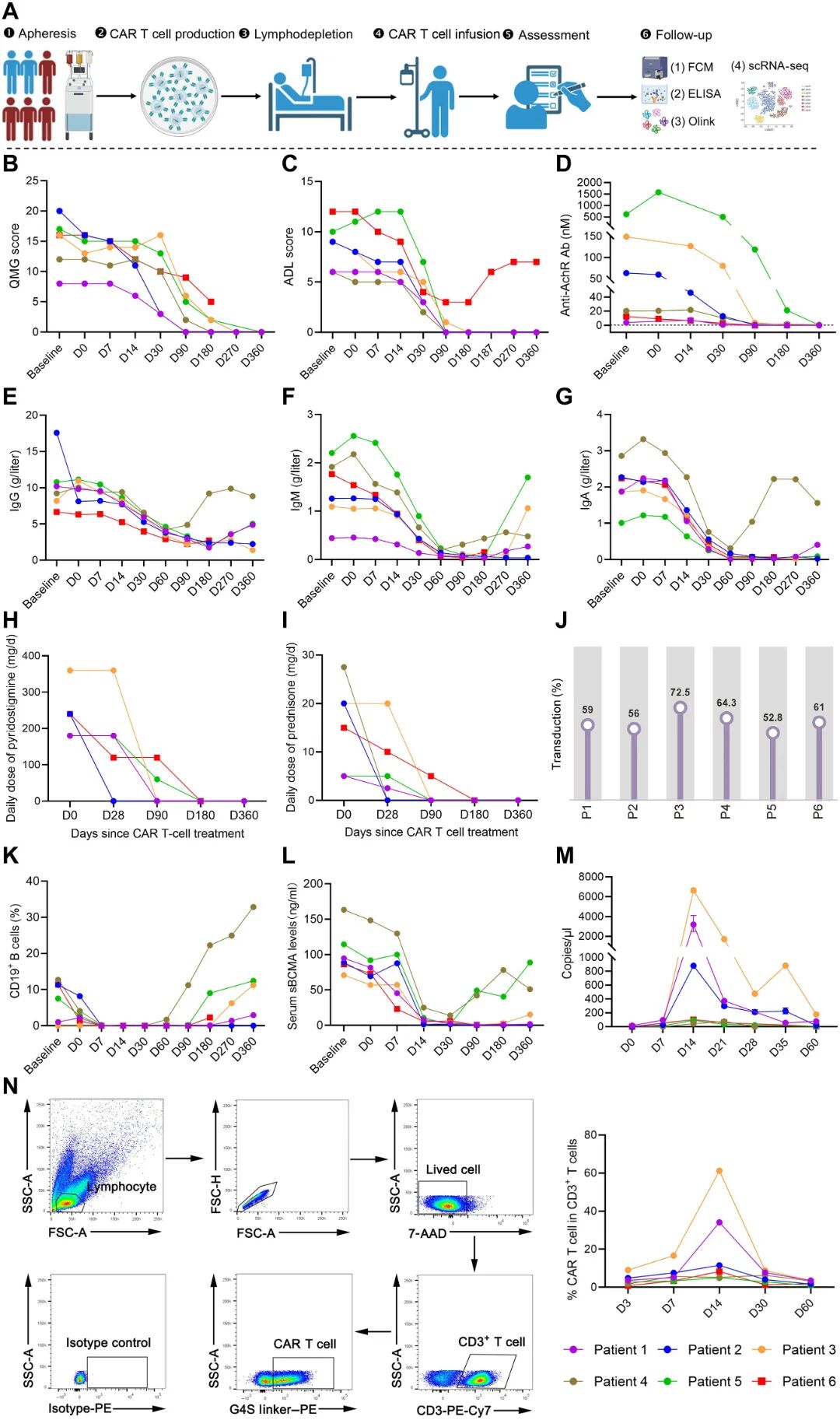
图1 CAR-T细胞输注后的CAR-T细胞动力学和临床评价
Result2 安全性监测
六例患者对CAR-T细胞疗法均表现出良好耐受性且安全性良好。未观察到任何CAR-T细胞相关的免疫效应细胞相关神经毒性综合征(ICANS)。队列中有两名患者(P1和P5)在输注后28天内出现1级细胞因子释放综合征(CRS),表现为轻度发热,经标准支持治疗后均缓解。值得注意的是,患者P5在第7天出现短暂性3级血液学毒性,包括白细胞减少(持续3天)和血小板减少(持续4天),这可能与淋巴细胞清除化疗相关。患者P3在治疗后第90天发生迟发性3级白细胞减少。P6在90天随访时出现并发性3级白细胞减少与4级中性粒细胞减少,经注射重组人粒细胞集落刺激因子后迅速缓解。患者P1和P3均在CAR-T细胞给药后28天发生迟发性2级细菌性肺炎(图2A-E)。对关键炎症介质(IL-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-12p70、IFN-α与IFN-γ以及TNF-α)的血清蛋白水平纵向监测显示,六例患者循环细胞因子浓度均未出现持续性异常升高(图2F)。
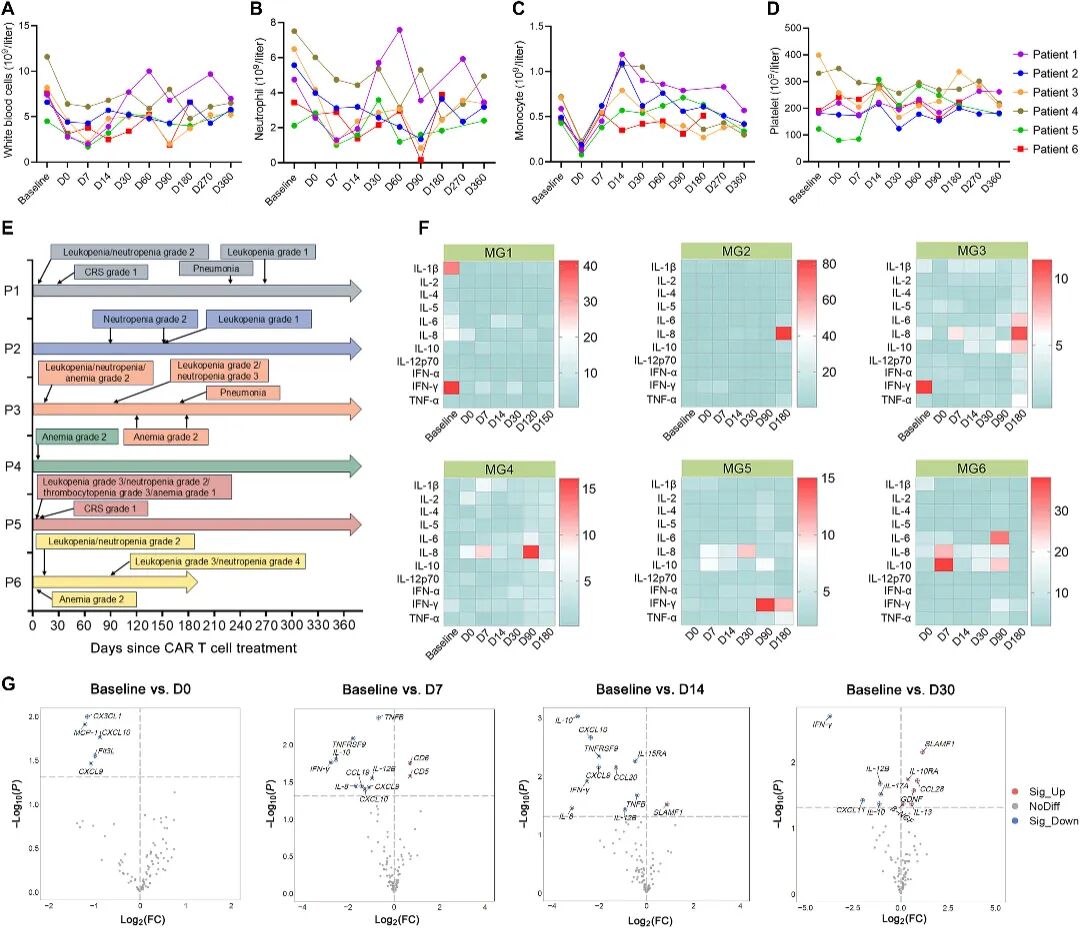
图2 CAR - T细胞输注后的安全性监测和炎症介质释放
Result3 CAR - T细胞输注后血清蛋白质组变化及B细胞功能重建
研究者采用Olink靶向蛋白组技术检测了92种炎症相关蛋白和92种免疫应答蛋白的血清表达水平。结果显示,在CAR-T细胞输注后的前14天内,包括CXCL9、CXCL10、TNFRSF9、IL-8、IL-10和IFN-γ在内的多种细胞因子呈现进行性升高,这些因子与增强CAR-T细胞迁移、减少细胞耗竭及提升细胞毒活性相关(图2G)。然而至第30天,上述细胞因子水平开始下降;抗炎介质、负向调控因子及T细胞活化标志物显著上调,同时促炎介质TREM1明显下调(图3A、B)。
五例患者于治疗后平均156±83天(图1K)实现B细胞重建(BCRC),而P2在12个月随访期间持续维持完全性B细胞再生障碍。表型分析显示,P1、P3、P4和P5重建的B细胞主要呈现初始B细胞表型(CD19⁺CD27⁻IgD⁺)(图3C),且下调B细胞活化/抗原呈递标志物(图3D)及促炎因子,并伴随免疫调节因子 IL-10的上调(图3E)。值得注意的是,P6于第187天疾病复发。第180天样本对比分析显示,相较于基线水平,该患者出现:年龄相关B细胞(ABCs,CD21⁻CD11c⁺T-bet⁺)与浆细胞(CD38⁺CD138⁺)的显著扩增,并上调B细胞活化标志物及促炎因子表达(图3C-E)。
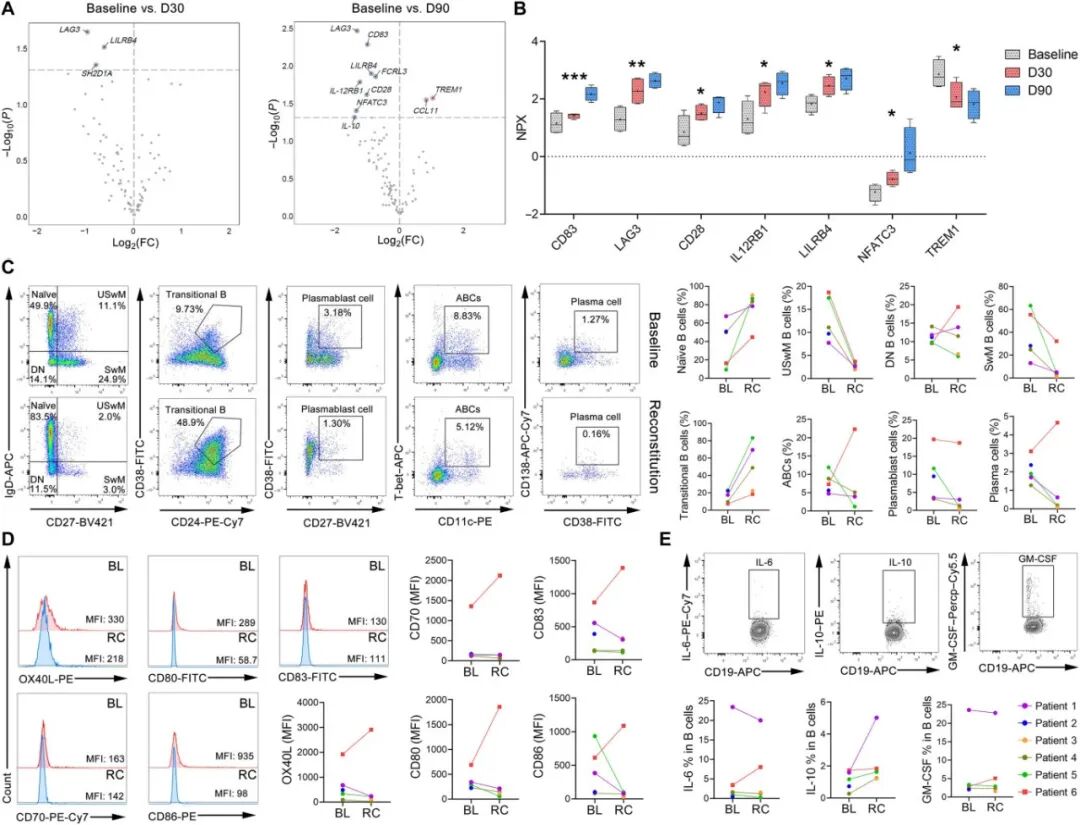
图3 CAR - T细胞输注后血清蛋白质组和B细胞功能的改变
Result4 单细胞测序揭示了复发患者全面的细胞图谱
为探究复发机制,研究者对复发患者P6的治疗前与治疗后第180天配对样本(包括PBMC及骨髓)进行了单细胞转录组和免疫组库测序。分析结果显示,外周血中年龄相关B细胞(ABCs)扩增,骨髓中浆细胞扩增(图4C)。差异基因分析鉴定出在PBMC和骨髓的B细胞中存在共有的203个上调、109个下调基因(图4D、E),上调基因富集于B细胞受体(BCR)信号通路、B细胞活化/增殖/分化、抗原呈递与细胞因子产生通路(图4F)。CellChat细胞通讯分析显示治疗后细胞通讯增强(图4G),并重建B细胞/浆细胞与其他细胞间的配体-受体信号通路。通过整合转录组与BCR组库的高分辨率克隆追踪表明,B细胞整体保持单克隆状态,并在治疗后出现独特的高度扩增克隆(图4I),且BCR测序显示未经类别转换的IgM重链占主导而IgG/IgA缺失(图4J)。
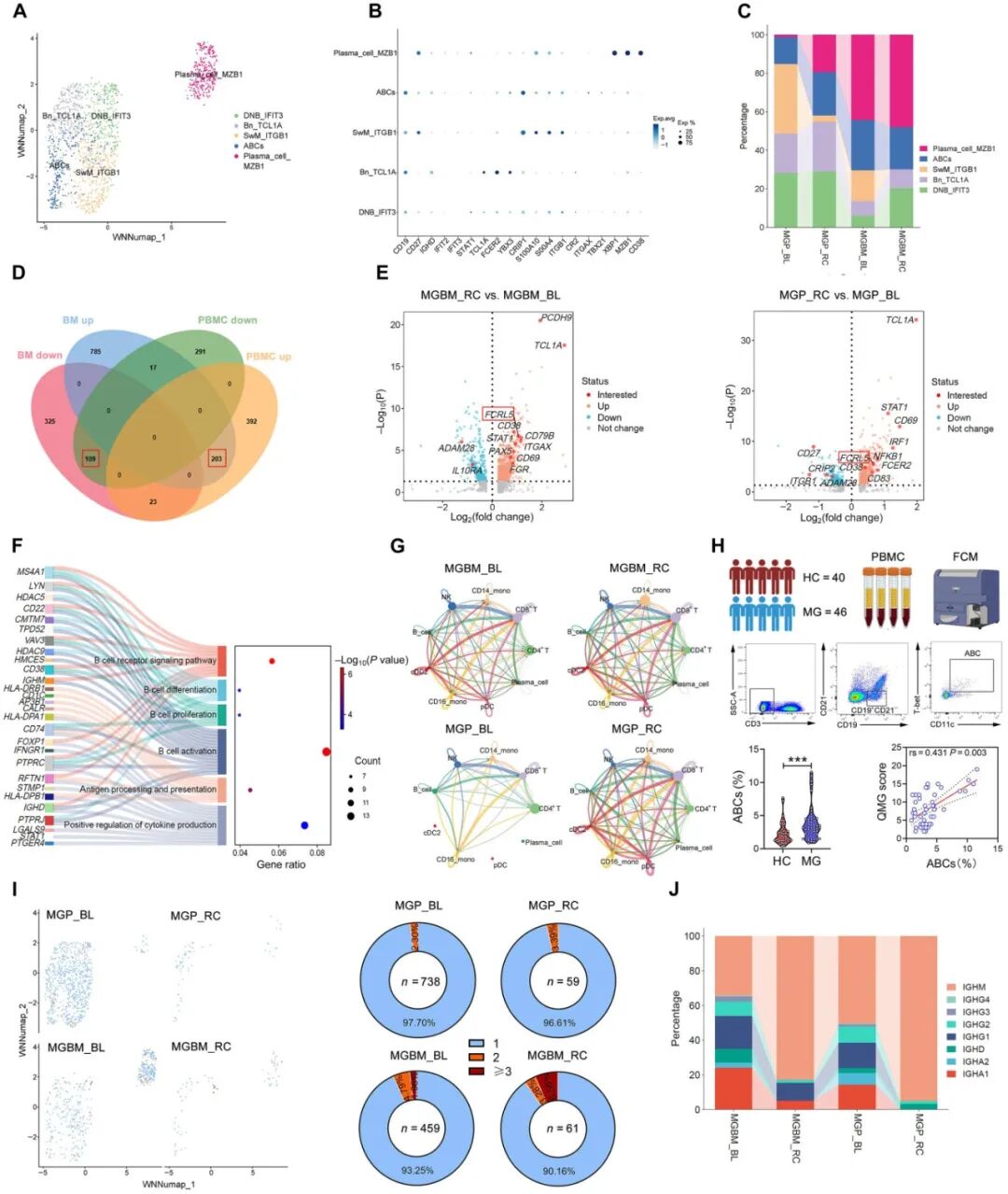
图4 单细胞测序揭示了P6在CAR-T细胞治疗后复发的B细胞和BCR特征
通过单细胞转录组初步发现MG复发患者存在ABCs扩增,随后研究者在扩大队列(40例健康对照 vs 46例初治MG患者)中进一步通过流式细胞术进行验证,证实了新发MG病例同样存在显著的ABCs扩增(P < 0.001;图4H),且与QMG呈正相关(图4H)。拟时序分析进一步揭示沿ABCs向浆细胞分化路径中FCRL5逐渐上调(图5B)。值得注意的是,CAR-T治疗响应者(P1/P4/P5)在输注后ABCs、转换记忆B细胞(SwM B cells)、浆母细胞及浆细胞中均显示FCRL5下调,而无响应者(P6)则维持高FCRL5表达(图5D)。此外,经CD20单抗(利妥昔单抗)治疗后复发的MG患者同样出现ABCs扩增与FCRL5上调(图5D),分析显示这些患者的B细胞亚群中FCRL5显著过表达,且在ABCs亚群中表达强度最高(图5E)。
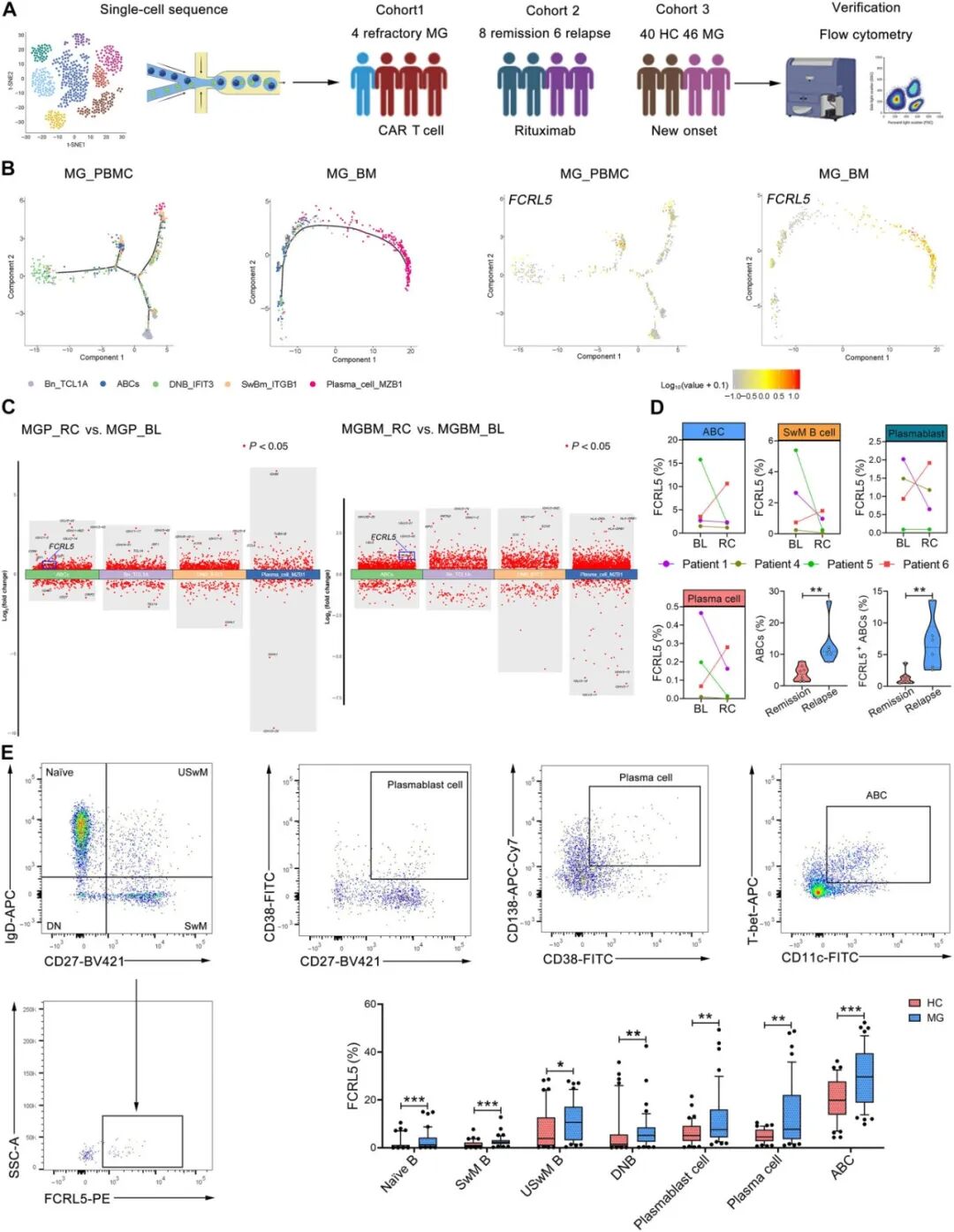
图5 FCRL5的拟时序分析及表达模式分析
随后,进一步系统性评估CAR-T细胞输注对T细胞稳态的动态影响,研究者观察到CD4⁺T细胞频率显著降低,并伴随CD8⁺T细胞比例代偿性升高,导致CD4/CD8比值倒置。为剖析B细胞调控的功能性后果,在三个关键阶段(基线期、B细胞耗竭期(BCD,输注后1个月)和B细胞重建期(BCRC,重建后3个月)分析T细胞应答:BCD期间,CD8⁺T细胞中关键细胞毒性效应分子显著上调,BCRC期多数标志物下降但IFN-γ持续高表达(图6G);而CD4⁺T细胞在BCD期呈现抗炎主导表型,BCRC期细胞因子水平逐渐回升(图6G);T细胞活化标志物(CD25/CD69/CD27)与抑制受体(TIGIT、Lag3、PD-1)评估显示,CD27与TIGIT在BCD期显著上调并于BCRC下降(CD4⁺/CD8⁺T细胞均如此)(图6H);复发患者P6的scRNA-seq验证了该表型——细胞毒性CD8⁺T细胞与活化CD8⁺T细胞扩增(图6C);骨髓及外周血CD4⁺/CD8⁺T细胞的KEGG通路富集分析揭示 TH17细胞分化、趋化因子信号、NF-κB信号、凋亡、吞噬及细胞毒性通路显著激活(图6E),TCR测序进一步证实克隆扩增增强(图6F)。
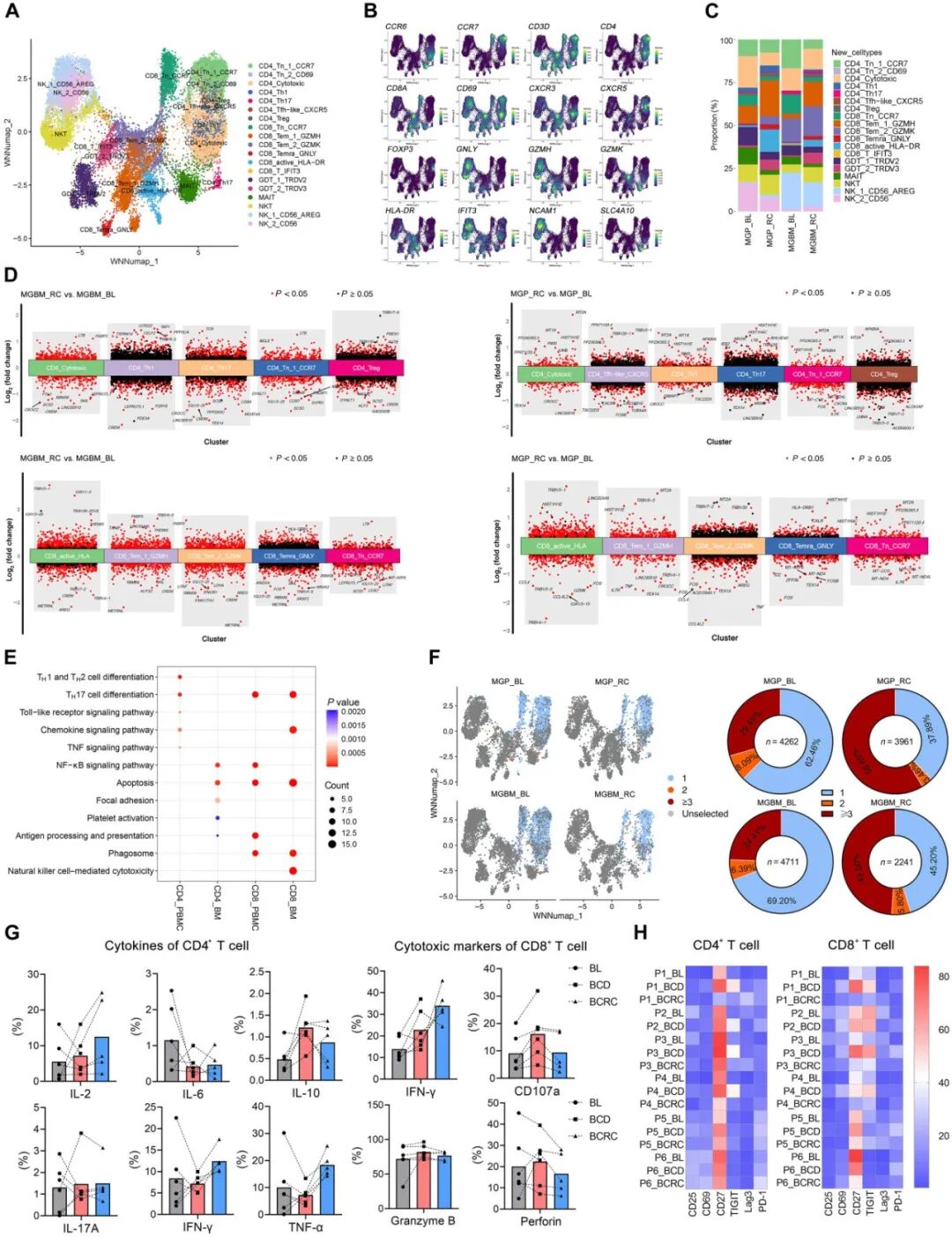
图6 T细胞功能重塑与单细胞测序揭示CAR-T治疗后复发患者P6的T细胞及TCR特征
研究结论
本研究首次报道了BCMA/CD19 CAR-T疗法在难治性重症肌无力患者中为期一年的随访数据,证实其疗效与安全性:核心发现包括五例患者实现无药物依赖的临床缓解,其抗AChR抗体水平或血清学转阴或逼近阈值,且全程保持优异的安全性(未发生严重不良事件);
率先通过血清蛋白动态与免疫表型时序监测,将"功能性免疫重置"概念从理论框架转化为临床实证;
首次揭示CAR-T治疗后复发机制,同时发现FCRL5作为既往未知的治疗靶点,在耐药人群中具有显著转化潜力。
参考文献:
Huang X, Zhang Z, Liu D, Luo T, An X, Yang M, Li S, Wang G, Li H, Cao J, Sun Z, Du X, Wang Z, Guo X, Ma T, Peng D, Qi G, Zong S, Ding Y, Cui G, Shi M, Zheng J, Zhang Y. BCMA/CD19 CAR T cell therapy for refractory myasthenia gravis: Proteomic signatures and single-cell transcriptomics of disease flares. Sci Adv. 2026 Jan 2;12(1):eaeb6424. doi: 10.1126/sciadv.aeb6424. Epub 2026 Jan 2. PMID: 41481736; PMCID: PMC12758533.






